5. पृष्ठ-रसायन LONG ANSWER TYPE QUESTIONS
प्रश्न 1. भौतिक अधिशोषण एवं रासायनिक अधिशोषण में क्या अन्तर है ?
उत्तर⇒ भौतिक अधिशोषण और रासायनिक अधिशोषण में निम्नलिखित अन्तर है-
भौतिक अधिशोषण
| (Physical Adsorption) | रासायनिक अधिशोषण |
| 1. इसकी अधिशोषण ऊष्मा अपेक्षाकृत कम होती है। अधिशोषण ऊष्मा 1-5 कि. कै, अधिशोषण के प्रति मोल होती है। | (Chemical Adsorption) 1. इसकी अधिशोषण ऊष्मा अपेक्षाकृत अधिक होती है। अधिशोषण ऊष्मा 20-100 कि. कै. अधिशोष्य के प्रति मोल होती |
| 2. भौतिक अधिशोषण साम्य काफी शीघ्रता (more readily) से स्थापित होता है सामान्यतः उत्क्रमणीय (reversible) होता है। | 2. रासायनिक अधिशोषण साम्य अपेक्षाकृत धीरे-धीरे स्थापित होता है और यह अनुत्क्रमणीय (irreversiblel) होता है। |
| 3. ये कमजोर वान्डर वाल बल से जुड़े रहते हैं। | 3. ये मजबूत रासायनिक बन्धन बनाते हैं। |
| 4. इसमें बहुस्तर (multi layers) बनते हैं। | 4. इसमें एक-अणुक स्तर (Unimolecular layer) बनता है। |
| 5. दाब के बढ़ने से अधिशोषण का वेग काफी बढ़ जाता है।
| 5. अधिशोषण में दाब के वृद्धि का प्रभाव नगण्य घटता है।
|
प्रश्न 2. बहुअणुक एवं वृहदागुण कोलॉइड में क्या अन्तर है? प्रत्येक का एक-एक उदाहरण दीजिए। सहचारी कोलॉइड इन दोनों प्रकार के कोलॉइडों से कैसे भिन्न हैं ?
उत्तर⇒ अवयवों का आकार व प्रकृति के आधार पर कोलॉइडों को निम्न रूप से वर्गीकृत किया जा सकता है
(क) बहुआण्विक कोलॉइड (ख) वृहदाण्विक कोलॉइड (ग) सहचारी कोलॉइड (मिसेल)।
(क) बहआण्विक कोलॉइड-विलीन करने पर किसी पदार्थ के बहुत-से परमाणु या लघु अणु एकत्रित होकर पूँज जैसी ऐसी स्पीशीज बनाते हैं। जिनका आकार कोलॉइडी सीमा (व्यास < 1 mm) में होता है। इस प्रकार प्राप्त स्पीशीज बहु आण्विक कोलॉइड कहलाती है। जैसे-एक गोल्ड सोल में अनेक परमाणु युक्त भिन्न-भिन्न आकारों के कण हो सकते हैं। सल्फर सॉल में एक हजार या उससे भी अधिक S8 सल्फर अणु वाले कण उपस्थित होते हैं।
(ख) वृहदाण्विक कोलॉइड-बृहदाणु उचित विलायकों में ऐसे विलयन बनाते हैं जिनमें वृहदाणुओं का आकार कोलॉइडी सीमा में होता है। ऐसे निकाय वृहदाण्विक कोलॉइड कहलाते हैं। ये कोलॉइड बहुत स्थायी होते हैं जैसे-स्टार्च, सेलुलोज, प्रोटीन और एन्जाइम।
(ग) सहचारी कोलॉइड (मिसेल)-कुछ पदार्थ ऐसे हैं जो कम सान्दताओं पर सामान्य प्रबल वैद्युत अपघट्य के समान व्यवहार करते हैं परन्तु उच्च सान्द्रताओं पर कणों का पंज बनने के कारण कोलॉइड के समान व्यवहार करते हैं इस प्रकार पूँजित कण मिसेल कहलाते हैं ये सहचारी कोलॉइड भी कहलाते हैं। मिसेल केवल निश्चित ताप से अधिक ताप पर बनते हैं जिसे क्राफ्ट ताप कहते हैं। जैसे–साबुन, अपमार्जक आदि ।
प्रश्न 3. एन्जाइम क्या होते हैं ? एन्जाइम उत्प्रेरण की क्रिया-विधि को संक्षेप में लिखिए।
उत्तर⇒ एन्जाइम जटिल नाइट्रोजनी कार्बनिक यौगिक है जो कि जीवित पौधों एवं जन्तुओं द्वारा उत्पन्न किए जाते हैं। वास्तविक रूप में से उच्च अणु द्रव्यमान वाले प्रोटीन अणु हैं जो जल में कोलॉइडी विलयन बनाते हैं। ये बहुत प्रभावी उत्प्रेरक होते हैं जो अनेक विशेष रूप से प्राकृतिक प्रक्रमों से संबंधित अभिक्रियाएँ को उत्प्रेरित करते हैं। जन्तु एवं पौधों में जीवन प्रक्रम के अनुरक्षण के लिए होनेवाली अनेक शारीरिक अभिक्रियाएँ, एन्जाइमों द्वारा उत्प्रेरित होती है। अतः एन्जाइमों के लिए जैवरासायनिक उत्प्रेरक शब्द का प्रयोग होता है एवं उत्प्रेरण की परिघटना जैवरासायनिक उत्प्रेरण कहलाती है।
इक्षु शर्करा का प्रतिलोपन इन्वर्टेज एन्जाइम इक्षु शर्करा को ग्लूकोज एवं फ्रक्टोज में परिवर्तित कर देता है।
C12H22O11aqs + H2O (l)![]() C6H12P6 + C6H12O6
C6H12P6 + C6H12O6
. ग्लूकोज फ्रक्टोज
एन्जाइम उत्प्रेरक की क्रियाविधि-एन्जाइम के कोलॉइडी कणों की सतहों पर बहुत सारे कोटर होते हैं ऐसे कोटर अभिलक्षणिक आकृति के होते हैं एवं इनमें सक्रिय समूह जैसे-NH2, -COOH, -SH, -OH. आदि होते हैं । वास्तव में यह सतह पर उपस्थित सक्रिय केन्द्र होते हैं। अभिक्रिया के अणु जिनकी परिपूरक आकृति होती है, इन कोटरों में एक ताले में चाबी के समान फिट हो जाते हैं। सक्रिय समूहों की उपस्थिति के कारण एक सक्रिय संकुल बनता है जो विघटित होकर उत्पाद देता है।
अतः इस प्रकार, एन्जाइम उत्प्रेरित अभिक्रियाओं का दो पदों में सम्पन्न होना माना जा सकता है।
E + S ![]() [E – S] → E + P
[E – S] → E + P
पद-1 सक्रियता संकुल बनाने के लिए एन्जाइम का सबस्ट्रेट आबंधन
E + S → ES*
पद-2 उत्पाद बनाने के लिए सक्रियता संकुल का विघटन
ES* + E + P
प्रश्न 4. उत्प्रेरक की सक्रियता एवं वरणक्षमता का क्या अर्थ है ?
उत्तर⇒ किसी उत्प्रेरक की योग्यता या सक्रियता निम्न दो बातों पर निर्भर करती है
मा सक्रियता बहत सीमा तक उत्प्रेरक की सक्रियता रसावशोषण की प्रबलता पर निर्भर करती है। सक्रिय होने के लिए अभिक्रियक, उत्प्रेरक पर पर्याप्त प्रबलता से अधिशोषित होने चाहिए। तथापि वे इतनी प्रबलता से अधिशोषित नहीं होने चाहिए कि वे गतिहीन हो जाएँ एवं अन्य अभिक्रियाओं
के लिए उत्प्रेरक की सतह पर कोई स्थान रिक्त न रहे। हाइड्रोजन अभिक्रियाओं के लिए यह पाया गया है कि उत्प्रेरकों सक्रियता आवर्त सारणी में वर्ग 5 से 11 के तत्वों तक बढ़ती है, जिनमें वर्ग 7 से 9 के तत्व अधिकतम सक्रियता दर्शाते हैं।
2H2(g) + O2(g)![]() 2H2O(l)
2H2O(l)
(ii) वरणात्मकता (चयनात्मकता)-किसी उत्प्रेरक की वरणात्मकता उसकी किसी अभिक्रिया को दिशा देकर एक विशेष उत्पाद बनाने की क्षमता है जैसे-H2 एवं CO से प्रारंभ करके एवं भिन्न उत्प्रेरकों के प्रयोग से हम भिन्न-भिन्न उत्पाद प्राप्त कर सकते हैं।
(i) CO(g) + 3H2(g)![]() CH4 (g) + H2O(g)
CH4 (g) + H2O(g)
(ii) CO(g) + 2H2(g)![]() CH3OH(g)
CH3OH(g)
(iii) CO(g) + H2(g)![]() HCHO(g)
HCHO(g)
अतः उत्प्रेरक के कार्य की प्रकृति अत्यधिक विशिष्ट होती है, अर्थात् कोई पदार्थ एक विशेष अभिक्रिया के लिए ही उत्प्रेरक हो सकता है, सभी अभिक्रियाओं के लिए नहीं। अर्थात् एक पदार्थ जो एक अभिक्रिया में उत्प्रेरक का कार्य करता है, अन्य अभिक्रियाओं को उत्प्रेरित करने में असमर्थ हो सकता है।
प्रश्न 5. साबुन की क्रिया पायसीकरण एवं मिसेल बनने के कारण होती है, इस पर टिप्पणी कीजिए।
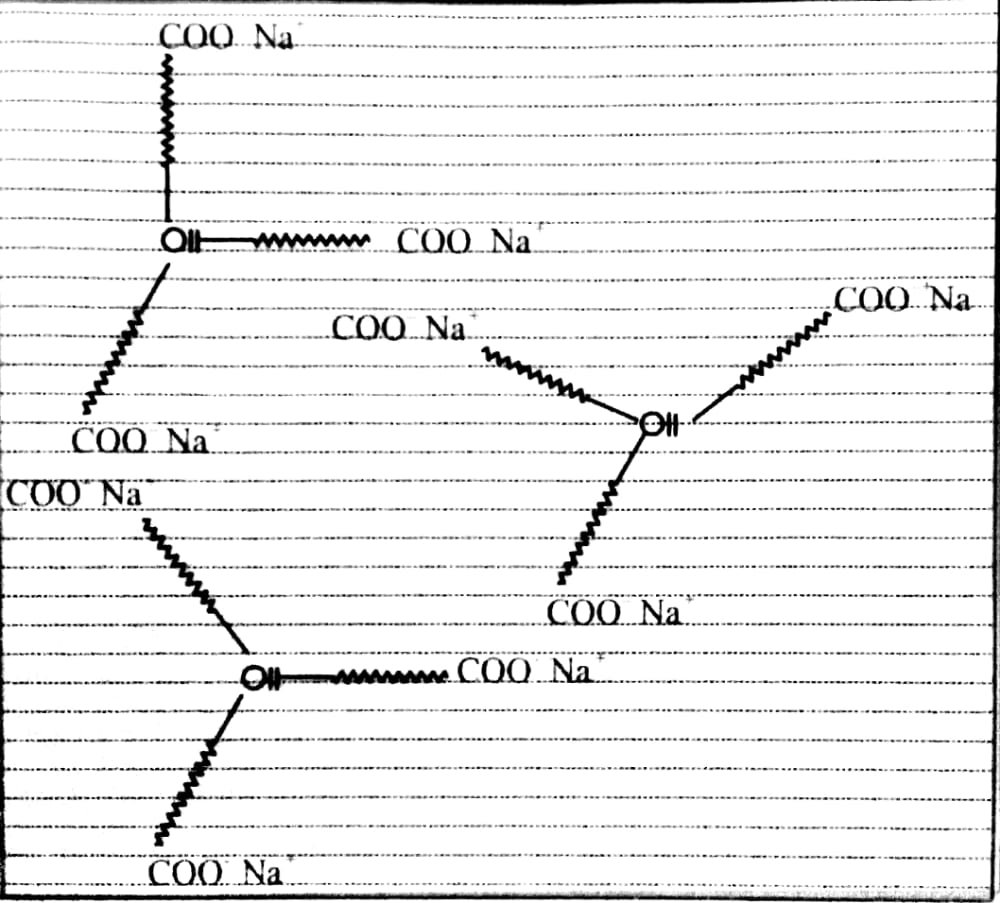 उत्तर⇒ साबुन तथा अपमार्जक दोनों शोधन कार्य मिसेल के रूप में इमल्शन बना कर करते हैं। इमल्शन बनने के कारण जल का पृष्ठ तनाव कम हो जाता है। साबुन तथा अपमार्जक के अणु की संरचना में एक सिरा जल स्नेही व दूसरा लम्बी हाइड्रोकार्बन शृंखला वाला सिरा जल विरोधी होता है।
उत्तर⇒ साबुन तथा अपमार्जक दोनों शोधन कार्य मिसेल के रूप में इमल्शन बना कर करते हैं। इमल्शन बनने के कारण जल का पृष्ठ तनाव कम हो जाता है। साबुन तथा अपमार्जक के अणु की संरचना में एक सिरा जल स्नेही व दूसरा लम्बी हाइड्रोकार्बन शृंखला वाला सिरा जल विरोधी होता है।
CH2(CH2)15 CH2-COO–Na+
पूँछ सिर
अनेक अणुओं के हाइड्रोकार्बन सिरे मैल या तेल को चारों तरफ से घेर लेते हैं तथा सल्फोनिया सिरे दूर हटे होने से मिसेल बन जाते हैं। इन्हीं मिसेलों के कारण धूल या तेल कण कपड़े से अलग हो जाते हैं।
प्रश्न 6. निम्न पदों (शब्दों) को समझाइए
(i) वैद्युत कण संचलन, (ii) स्कंदन, (iii) अपोहन, (iv) टिन्डल प्रभाव।
उत्तर⇒ (i) वैद्युत कण संचलन-
कोलॉइडी कणों पर आवेश की
उपस्थिति वैद्युत कण संचलन प्रयोग
प्रारम्भिक से संपुष्ट होती है। जब
एक कोलाइडी विलयन में स्तर डूब
हुए दो प्लैटिनम इलैक्ट्रोडों पर विद्युत
विभव लगाया जाता है तो कोलॉइडी
कण एक या दूसरे इलैक्ट्रोडों की
ओर गमन करते हैं। विद्युत विभव
के प्रभाव में कोलॉइडी कणों का
संचलन वैद्युत कण संचालन कहलाता
है। धनात्मक आवेशित कण कैथोड की ओर जबकि ऋणात्मक आवेशित कण ऐनोड की ओर गति करते हैं।
जब किसी उपयुक्त प्रकार के कण संचलन अर्थात् कणों की गति रोकी जाती है तो यह देखा जाता है कि परिक्षेपण माध्यम विद्युत क्षेत्र में गति करना प्रारम्भ कर देता है। यह परिघटना वैद्युत परासरण कहलाती है।
(ii) स्कंदन-द्रवविरागी सॉल का स्थायित्व कोलॉइडी कणों पर आवेश के कारण होता है। यदि किसी प्रकार आवेश हटा दिया जाये तो कण एक-दूसरे के समीप आकर पुंजित हो जायेंगे एवं गुरुत्व बल के कारण नीचे बैठ जायेंगे। कोलॉइडी कणों के नीचे बैठ जाने का प्रक्रम सॉल का स्कंदन या अवक्षेपण कहलाता है।
(iii) अपोहन यह एक उपयुक्त झिल्ली द्वारा अपोहन करके कोलॉइडी विलयन में से घुले हुए पदार्थों को निकालने का प्रक्रम है। चूंकि वास्तविक विलयन के कण जातव झिल्ली, पार्चमेन्ट पत्र या सेलोफेन शीट में से निकल सकते हैं, परन्तु कोलॉइडी कण नहीं, अतः झिल्ली को अपोहन में प्रयुक्त किया जाता है। इस उद्देश्य के लिए प्रयुक्त उपकरण अपोहक कहलाता है। कोलॉइडी विलयन से भरा एक उपयुक्त झिल्ली का बैग एक पात्र में लटकाया जाता है जिसमें से होकर जल निरंतर बहता रहता है। अणु एवं आयन झिल्ली से विसरित बाहरी जल में आ जाते हैं एवं शुद्ध कोलॉइडी विलयन शेष रह जाता है।
(iv) टिन्डल प्रभाव यदि अंधेरे में रखा एक समांगी विलयन प्रकाश की दिशा से देखा जाए तो यह स्वच्छ दिखाई देता है परन्तु इसे प्रकाश के पथ की दिशा में समकोण दिशा में देखने पर वे मंद से प्रबल दूधियापन दर्शाते हैं। यह प्रभाव टिन्डल प्रभाव कहलाता है।
प्रश्न 7. (क) निम्न को परिभाषित करें :
(i) अधिशोषक (ii) विशेषांक (iii) अवशोषण (iv) अधिशोषण एन्थेल्पी (v) अधिशोषण प्रतियोगिता।
(ख) विलयन में अधिशोषण कैसे उत्पन्न होता है ?
उत्तर⇒ (क) (i) अधिशोषक-अणुक स्पीशीज या पदार्थ जो पृष्ठ पर सांद्रित या संचित होना अधिशोषण कहलाता है तथा पदार्थ जिसके पृष्ठ पर अधिशोषण होता है। अधिशोषक कहलाता है।
(ii) विशेषांक-अधिशोष्य पदार्थ को अधिशोषण से दूर करना विशोषण कहलाता है। विशोषण पदार्थ को गरम करने या दाब कम करने पर होता है।
(iii) अवशोषण-अवशोषण प्रक्रम में पदार्थ में ठोस के संपूर्ण स्थूल में समान रूप से वितरित हो जाता है। उदाहरण-अमोनिया जल द्वारा अवशोषित किया जाता है जबकि चारकोल द्वारा अमोनिया का अधिशोषण होता है। इसी प्रकार अजलीय CaCl2 द्वारा जलवाष्प का अवशोषण किया जाता है परन्तु सिलिका जेल द्वारा अधिशोषण होता है।
(iv) अधिशोषण एन्थैल्पी-अधिशोषक के पृष्ठ पर 1 मोल अधिशोष्य का अधिशोषण में एन्थैल्पी परिवर्तन अधिशोषण से अधिक होती है। रसायन अधिशोषण में ऊर्जा परिवर्तन 40-400 kJ/मोल है। जबकि भौतिक अधिशोषण में ऊर्जा परिवर्तन 40 kJ/मोल है।
यह भी देखा गया है कि अधिशोषण में ऐन्थैल्पिक मान घटता है। अतः अधिशोषण प्रक्रम के लिए ΔH = + ve, ΔS = + ve, AG = – ve

(v) अधिशोषण प्रतियोगिता-भिन्न-भिन्न अधिशोषकों के बीच अधिशोष्यों को अधिशोषण के लिए एक प्रतियोगिता होती है। अधिक प्रबलता से अधिशोषण होने वाले पदार्थ दुर्बल अधिशोषक की ओर गति करते हैं। उदाहरण-गैस मास्क में लिया गया चारकोल द्वारा O2, N3 आदि जैसी गैसें पहले ही अधिशोषित होती हैं। लेकिन जहरीली गैसें जैसे-CH4 और Cl2 आदि को अधिशोषित किया जाता है।
अतः जब गैसों के मिश्रण को अधिशोषण के लिए अधिशोषक के समीप रखा जाता है तब प्रबलता से अधिशोषित होनेवाली गैस आसानी से अधिशोषित होती है।
उदाहरण-वायु में उपस्थित वाष्प सिलिका जेल द्वारा अधिशोषित होते हैं।
(ख) विलयन द्वारा अधिशोषण-ठोस, विलयनों से भी घुले हुए पदार्थों का अधिशोषण कर सकते हैं। जैसे-जब ऐसीटिक अम्ल का जलीय विलयन को चारकोल के साथ हिलाया जाता है तो अम्ल का एक अंश चारकोल के द्वारा अधिशोषित हो जाता है एवं विलयन में अम्ल की सान्द्रता घट जाती है।
फ्रॉयन्डलिक समीकरण विलयनों से अधिशोषण के व्यवहार का इस अंतर के साथ सन्निकट वर्णन करती है।
![]() = kc1/nn >1 ….(i)
= kc1/nn >1 ….(i)
फ्रायन्डलिक अधिशोषक समतापी
![]() ….(ii)
….(ii)
यह लैंग्मयूर अधिशोषण समतापी कहलाता है।
समीकरण (i) व (ii) से ठोस द्वारा गैसों का अधिशोषण ज्ञात किया जाता है।
प्रश्न 8. निम्न पर संक्षिप्त टिप्पणी लिखें :
(i) समांगी उत्प्रेरण (ii) विषमांगी उत्प्रेरण (iii) एन्जाइम उत्प्रेरण।
उत्तर⇒ (i) समांगी उत्प्रेरण-जब अभिक्रिया एवं उत्प्रेरक समान प्रावस्था में हों तो प्रक्रम समांगी उत्प्रेरण कहलाता है। समांगी उत्प्रेरण निम्न हैं-
(a) RCOOR1 (l) + H2O(l) ![]() RCOOH + R1OH
RCOOH + R1OH
कार्बनिक एस्टेट कार्बोक्सिल अम्ल एल्कोहल
(b) 2CO(g) + O2(g) ![]() 2CO2(g)
2CO2(g)
(c) C12H22O11 (aqs) + H2O (l) ![]() C6H12O6 + C6H12O6
C6H12O6 + C6H12O6
. ग्लूकोस फ्रुक्टोस
(ii) विषमांगी उत्प्रेरण-उत्प्रेरक जिसमें अभिक्रियक एवं उत्प्रेरक निम्न प्रावस्थाओं में होते हैं, विषमांगी उत्प्रेरण कहलाता है।
(a) Pt की उपस्थिति में सल्फर डाइऑक्साइड का सल्फर ट्राइऑक्साइड में ऑक्सीकरण
2SO2 (g) ![]() 2SO3(g)
2SO3(g)
(b) वनस्पति तेल (l) + H2![]() वसा (s)
वसा (s)
(c) N2(g) + 3H2(g)![]() 2NH2(g)
2NH2(g)
(d) CO(g) + 2H2(g)![]() CH3OH(l)
CH3OH(l)
(e) H2C = CH2 + H2![]() CH3 – CH3
CH3 – CH3
(iii) एन्जाइम उत्प्रेरण-एन्जाइम जटिल नाइट्रोजनी कार्बनिक यौगिक है जो कि जीवित पौधे एवं जन्तुओं द्वारा उत्पन्न किए जाते हैं।
ये उच्च अणु द्रव्यमान वाले प्रोटीन अणु है जो जल में कोलॉइडी विलयन बनाते हैं। एन्जाइम का एक अणु अभिक्रियक के दस लाख अणुओं को प्रति मिनट परिवर्तित कर सकता है।
उदाहरण- NH2CONH2 + H2O![]() 2NH3 + 2CO2 प्रत्येक एन्जाइम की विशिष्टता किसी एक अभिक्रिया के लिए होती है। एन्जाइम उत्प्रेरित अभिक्रिया दो पदों में सम्पन्न होती है।
2NH3 + 2CO2 प्रत्येक एन्जाइम की विशिष्टता किसी एक अभिक्रिया के लिए होती है। एन्जाइम उत्प्रेरित अभिक्रिया दो पदों में सम्पन्न होती है।
E + S ![]() (E – S) → E + P
(E – S) → E + P
पद (i)-सक्रिय संकुल बनाने के लिए एन्जाइम का सबस्ट्रेट से आबंधन
E + S → ES
पद (ii)-उत्पाद बनाने के लिए संक्रियत संकुल का विघटन
ES → E + P
प्रश्न 9. अधिशोषण और अवशोषण में आप कैसे विभेद करेंगे ?
उत्तर-अधिशोषण और अवशोषण के बीच विभेद (Distinction between adsorption and absorption)-अधिशोषण और अवशोषण के बीच स्पष्ट अन्तर है। अधिशोषण अन्तर हैं अधिशोषण एक पृष्ठीय घटना है तथा इसमें ठोस या द्रव अधिशोषक पदार्थ के आण्विक स्पीशिज को अपने पृष्ठ पर धारण (retain) करते हैं, किन्तु अपने परिमाण के अन्दर नहीं जाने देते हैं। इसके विपरीत अवशोषण में पदार्थ के आण्विक स्पीशिज ठोस या द्रव के सिर्फ पृष्ठ से चिपके नहीं रहते हैं, बल्कि उसके परिमाण के अन्दर भी समरूप तरीके से वितरित (distributed) हो जाते हैं। इस प्रकार स्पष्ट होता है कि अधिशोषण में अधिशोषित की सांद्रता में अधिशोषक के सिर्फ पृष्ठ पर वृद्धि होती है, जबकि अवशोषण में अवशोषित पदार्थ के सान्द्रण में अवशोषक पदार्थ के सम्पूर्ण पिण्ड (body) में वृद्धि समरूप होती है। उदाहरणार्थ स्पांज (sponge) जल को तथा P2O5 और निर्जल CaCl2 जलवाष्प का अवशोषित करते है। चॉक (Chalk) के पृष्ठ पर स्याही (ink) तथा चारकोल के पृष्ठ पर घोल में ऐसिटिक अम्ल और अक्रियाशील (inen) गैसों जैसा अनेक गैसें अधिशोषित होती हैं। अमोनिया गैस जल में अवशोषित होती है जबकि चारकोल के पृष्ठ पर अधिशोषित होती है। अधिशोषण और अवशोषण की घटनाओं को निम्नांकित प्रकार से निरूपति कर सकते हैं-
 प्रश्न 10. अधिशोषण को प्रभावित करने वाले कौन-कौन से कारक है ?
प्रश्न 10. अधिशोषण को प्रभावित करने वाले कौन-कौन से कारक है ?
उत्तर⇒ अधिशोषण को प्रभावित करने वाला कारक-अधिशोषण को निम्नांकित कारक प्रभावित करते हैं-
(i) तापमान का प्रभाव (Effect of Temperature)-अधिशोषण की घटना में ऊष्मा ऊर्जा मुक्त होती हैं अतः ली शेंटेलियर सिद्धान्त के अनुसार, तापमान में वृद्धि होने पर अधिशोषण की सीमा कम जाती है।
उदाहरणार्थ, 660 मिमी दाब पर 1 ग्राम चारकोल 0°C पर 10C.C नाइट्रोजन, तथा 29°C पर 20C.C नाइट्रोजन तथा-78°C पर 45.C.C. नाइट्रोजन को अधिशोषित करता है।
(ii) दाब अथवा सान्द्रण का प्रभाव-चूंकि किसी ठोस के पृष्ठ पर गैस के अधिशोषण की घटना में गैस के दाब में कमी होती है, ली शैटेलियर सिद्धान्त के अनुसार गैस के दाब में वृद्धि होने पर गैस के अधिशोषण का परिमाण बढ़ जाता है। ठोस अधिशोषक के प्रति इकाई क्षेत्रफल (area) या द्रव्यमान (mass) पर गैस के अधिशोषण के परिमाण का दाब के साथ विवरण व्यक्त करने के लिए फ्रायण्डलिक (Freundich : 1909) ने एक समीकरण दिया है जो निम्नांकित प्रकार है-
![]() – KP1/n
– KP1/n
m
प्रश्न 11. ठोसों द्वारा गैसों के अधिशोषण पर दाब एवं ताप के प्रभाव की विवेचना कीजिए।
उत्तर⇒ ठोस पर गैस के अधिशोषण के लिए दाब का प्रभाव-दाब के प्रभाव को फ्रॉयन्डलिक अधिशोषण समतापी द्वारा वर्णित किया जा सकता है। अधिशोषण एक उत्क्रमणीय प्रक्रम होता है और इसे दाब को कम कर प्राप्त किया जा सकता है। इसलिए यह संभव है कि दाब बढ़ने पर अधिशोषण
बढता है। साम्य दाब Ps पर ![]() का मान अधिकतम होता है और इससे अधिक अधिशोषण नहीं हो सकता चाहे दाब को और अधिक बढ़ाया जाए।
का मान अधिकतम होता है और इससे अधिक अधिशोषण नहीं हो सकता चाहे दाब को और अधिक बढ़ाया जाए।
(i) कम दाब पर-(ग्राफ में A से B तक वक्र)
![]() p1
p1
![]() kp’ जहाँ k स्थिरांक है। स्थिर ताप
kp’ जहाँ k स्थिरांक है। स्थिर ताप ![]() व P मध्य ग्राफ Ps
व P मध्य ग्राफ Ps


समीकरण (1) व (2) फ्रॉयन्डलिक अधिशोषण समपाती समीकरण है जो गैस को ठोस द्वारा अधिशोषित करने पर दाब के प्रभाव को वर्णित करता है।
(ख) ताप का प्रभाव (ठोस द्वारा गैस के अधिशोषण पर) अधिशोषण एक वास्तविक साम्यावस्था है। इसमें दो विपरीत प्रक्रम संपन्न होते हैं (1) अधिशोषण (2) विअधिशोषण प्रक्रम

क्योंकि अधिशोषण एक ऊष्माक्षेपी प्रक्रम है।
इसलिए ली-चेटलियर सिद्धांत के अनुसार
ताप बढ़ने पर अधिशोषण घटता है।
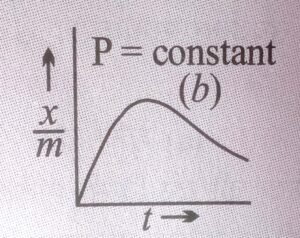
स्थिर दाब पर ![]() तथा तापमान के मध्य खींचा गया ग्राफ अधिशोषण समतापी वक्र कहलाता है। भौतिक अधिशोषण तथा रासायनिक अधिशोषण के लिए अधिशोषण समतापी वक्र निम्न हैं।
तथा तापमान के मध्य खींचा गया ग्राफ अधिशोषण समतापी वक्र कहलाता है। भौतिक अधिशोषण तथा रासायनिक अधिशोषण के लिए अधिशोषण समतापी वक्र निम्न हैं।
भौतिक अधिशोषण-दोनों समतापी वक्र एक दूसरे से भिन्न है, जहाँ
भौतिक अधिशोषण समतापी वक्र दर्शाता है कि ![]() का मान तापमान के बढ़ने पर घटता है, वहीं रासायनिक अधिशोषण समतापी वक्र पहले ताप के बढ़ने पर बढ़ता है लेकिन बाद में ताप के बढ़ने पर
का मान तापमान के बढ़ने पर घटता है, वहीं रासायनिक अधिशोषण समतापी वक्र पहले ताप के बढ़ने पर बढ़ता है लेकिन बाद में ताप के बढ़ने पर ![]() का मान घटता है।
का मान घटता है।