
2. विलयन LONG ANSWER TYPE QUESTIONS
प्रश्न 1. राउल्ट का वाष्प दाब का आपेक्षिक अवनमन का सिद्धांत क्या है ? सिद्ध करें कि विलय का मोलर द्रव्यमान वाष्प दाब के अवनमन के व्युत्क्रमानुपाती होता है।
उत्तर⇒ राउल्ट के नियम के अनुसार यदि किसी अवाष्पशील विलेय को शुद्ध विलायक में डालने पर विलयन का वाष्प दाब शुद्ध विलायक के वाष्प दाब से कम होता है।
वाष्प दाब का अवनमन के विलेय कणों के सान्द्रण पर निर्भर करता है।
राउल्ट के नियम के अनुसार वाष्पदाब का आपेक्षिक अवनमन का मान विलेय के मोल अंश के बराबर होता है।
यदि P0 शुद्ध विलायक का वाष्प दाब है तथा Ps विलयन का वाष्प दाब है तथा XB विलेय का मोल अंश है।
P0 > PS


अतः हम कह सकते हैं कि विलेय का मोलर द्रव्यमान वाष्प दाब के अवनमन के व्युत्क्रमानुपाती होता है।
जहाँ WB = विलेय की मात्रा, WA = विलायक की मात्रा
MA = विलायक का मोलर द्रव्यमान है।
प्रश्न 2. निम्न पदों को परिभाषित कीजिए : (i) मोल-अंश (ii) मोललता (iii) मोलरता (iv) द्रव्यमान प्रतिशत
उत्तर⇒ (i) मोल-अंश : मोल-अंश अवयव के मोलों की संख्या अवयवों के कुल मोलों की संख्या का अनुपात होता है।
माना एक द्विअंगी विलयन में A तथा B अवयवों के मोल क्रमशः nA व nB हैं तब
A का मोल–अंश xA = ![]()
B का मोल–अंश xB = ![]()
इसलिए xA + xB = 1 या xA = 1 – xB
(ii) मोललता : किसी विलयन की मोललता (m) 1 kg विलायक में उपस्थित विलेय के मोलों की संख्या के रूप में परिभाषित की जाती है।
![]()
(iii) मोलरता : एक लीटर विलयन में घुले हुए विलेय के मोलों की संख्या को उस विलयन की मोलरता (M) कहते हैं।
![]()
(iv) द्रव्यमान प्रतिशत (w/w) : विलयनों के अवयवों को द्रव्यमान प्रतिशत में निम्न प्रकार से परिभाषित किया जाता है-
![]()
यदि अवयव A द्रव्यमान wA तथा B अवयव का द्रव्यमान wB हो तो A के लिए द्रव्यमान %
![]()
प्रश्न 3. राउल्ट के नियम से धनात्मक एवं ऋणात्मक विचलन का क्या अर्थ है तथा DH मिश्रण के चिह्न का इन विचलनों से कैसे संबंधित है ?
उत्तर⇒ राउल्ट नियम से धनात्मक एवं ऋणात्मक विचलन :
1. धनात्मक विचलन : राउल्ट नियम से धनात्मक विचलन की स्थिति में A-B अन्योन्य क्रियाएँ A-A अथवा B-B के बीच अन्योन्य क्रियाओं की तुलना में कमजोर होती है अर्थात् इस स्थिति में विलेय-विलायक अणओं के मध्य अंतराण्विक आकर्षण बल विलेय–विलेय और विलायक-विलायक अणों की तुलना में कमजोर होते हैं परिणामस्वरूप वाष्प दाब में वृद्धि होती है जिससे धनात्मक विचलन होता है।
विलयन PA > P0A × xA
PB × P0B × xB
जहाँ PAPB विलयन में उपस्थित A और B अवयवों के आंशिक दाब है तथा P0A और P0B शुद्ध अवस्था में आंशिक दाब हैं।
XAXB विलयन अवयवों के मोल-अंश हैं।
यहाँ ΔH > 0 अर्थात् धनात्मक उदाहरण
(i) एथेनाल तथा n-हेक्सेन
(ii) CCl4 व CHCl3
2. ऋणात्मक विचलन : राउल्ट नियम से ऋणात्मक विचलन की स्थिति में A-A, एवं B-B के बीच अंतराआण्विक आकर्षण बल A-B की तुलना में कमजोर होता है । परिणामस्वरूप वाष्प दाब कम हो जाता है अतः ऋणात्मक विचलन प्रदर्शित होता है।
उदाहरण : क्लोरोफॉर्म एवं ऐसीटोन का मिश्रण भी ऐसा विचलन बनाता है जो राउल्ट के नियम के ऋणात्मक विचलन दर्शाता है। इसका कारण यह है कि क्लोरोफॉर्म का अणु ऐसीटोन के अणु के साथ हाइड्रोजन बंध बना सकता है जैसा कि चित्र में दर्शाया गया है।
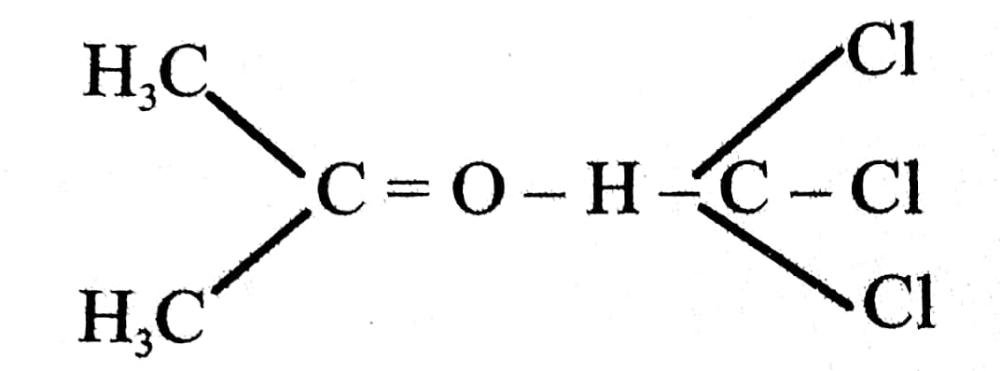
अनादर्श विलयन जो ऋणात्मक विचलन दर्शाते हैं।
(i) PA < P0A तथा PB < P0B xB
(ii) ΔV मिश्रण = ऋणात्मक
उदाहरण :
(i) जल + HCl
(ii) जल + NHO3
(iii) CH3COCH तथा C6H5NH2
(iv) CH3COOH और पाइरिडीन
प्रश्न 4. राउल्ट के नियम उड़नशील एवं अउड़नशील पदार्थों के लिए लिखें और व्याख्या करें। आदर्श आचरण से धनात्मक विचलन की व्याख्या उचित उदाहरण के साथ दें।
उत्तर⇒ राउल्ट केनियम उड़नशील पदार्थों के लिए किसी वाष्पशील द्रवों के विलयन के प्रत्येक अवयव का आंशिक दाब विलयन में उनके मोल अंश के समानुपाती होता है।
P1 ∝ X1 और P1 = P10 X1
जहाँ P10 = शुद्ध घटक 2 का समान ताप पर वाष्प दाब है। इसी प्रकार,
P2 ∝ X2 और P2 = P20 X2
जहाँ P2 = शुद्ध घटक 2 का समान ताप पर वाष्प दाब है।
राउल्ट के नियम अउडनशील पदार्थों के लिए- किसी विलयन में प्रत्येक वाष्पशील अवयव का आंशिक वाष्प दाब इसके मोल-अंश के समानुपाती होता है। विलयनों का वाष्पदाब राउल्ट के नियम द्वारा प्रायुक्त किए गए वाष्प दाब से या तो अधिक होता है या कम। यदि यह अधिक होता है तो यह विलयन राउल्ट नियम से धनात्मक विचलन प्रदर्शित करता है। अन्तराण्विक बल कमजोर हो जाने के कारण मिश्रण राउल्ट के नियम से धनात्मक विचलन दर्शाता है।
प्रश्न 5. परासरण तथा विसरण में क्या अन्तर है ?
उत्तर⇒ परासरण तथा विसरण में निम्नलिखित अन्तर है-
| परासरण | विसरण |
| 1. परासरण के लिए अर्द्धपारगम्य झिल्ली की आवश्यकता होती है। | 1. विसरण के लिए अर्द्ध पारगम्य झिल्ली की कोई आवश्यकता नहीं है । |
| 2. परासरण में सिर्फ घोलक के अणु तनु घोल से सान्द्र घोल की ओर तब तक जाता है जब तक साम्य की अवस्था प्राप्त नहीं हो जाए। | 2. विसरण में हल्की गैसें भारी गैसों की तुलना में अधिक तेजी से विसरित होती है। |
| 3. परासरण में पूरा तंत्र को विद्युतीय सेल माना जा सकता है। | 3. विसरण में पूरे तंत्र को विद्युतीय सेल नहीं माना जा सकता है। |
प्रश्न 6. निम्नलिखित पदों की व्याख्या करें-
(क) असामान्य अणु गुण (Abnormal Colligative Property)
(ख) वॉण्ट हॉफ गुणक (Van’t Hoff Factor)
उत्तर⇒ (क) असामान्य अणु गुण (Abnormal Coligative Property)-हमलोग जानते हैं अवाष्पशील तथा अचालक घुल्य के अणुआ की संख्या ठोस अवस्था तथा घोल में समान होती है। परन्तु यह स्थिति चालक घुल्य के साथ लागू नहीं होता है। इस घुल्य का घोल अवस्था की संख्या ठोस अवस्था तथा घोल में समान होती है। परन्तु यह स्थिति चालक घुल्य के साथ लागू नहीं होता है। इस घुल्य का घोल अवस्था में अणुओं की संख्या ठोस अवस्था के अणुओं की सख्या से हमेशा अधिक होती है। कणों के इस बढ़े मान से घोल के व्यवहार में भिन्नता उत्पन्न हो जाती है जिसे असामान्य व्यवहार कहते हैं तथा इस अणु को असामान्य अणुगुण (colligative property) कहा जाता है।
हम जानते हैं कि Colligative property ∝ कणों की संख्या
मान लिया कि A ![]() nB
nB
प्रारम्भ में 1 0
साम्यावस्था में 1-α nα
कुल कणों की संख्या (मोलों की संख्या) = 1 -+ α nα = 1 + nα – α = 1 + α (n-1)
मान लिया कि πth = सामान्य परासरण दाब
π0bs = प्रेक्षित परासरण दाब
ΔPth = सामान्य वाष्प दाब अवनमन
ΔP0bs = प्रेक्षित वाष्प दाब अवनमन
ΔTbTh = सामान्य क्वथनांक उन्नयन
ΔTbobs = प्रेक्षित क्वथनांक उन्नयन
ΔTsn = सामान्य हिमांक अवनमन
ΔTƒnobs = प्रेक्षित हिमांक अवनमन

(ख) वाण्ट हॉफ गुणांक (Van’t Hoff Factor)-वाण्ट हॉफ ने तनु विलयनों का निम्न समीकरण दिया- πV = ST जबकि π = परासरण दाब, V
= मोलर आयतन, S = विलयन स्थिरांक, T = परम तापक्रम
कुछ पदार्थ विलयनों में सामान्य से कम अथवा अधिक आता है। इस व्यवहार को समझने के लिए वाण्ट हॉफ ने विलयन समीकरण में निम्न संशोधन सुझाया- πV = iST
जबकि i वाण्ट हॉफ फैक्टर है। वाण्ट हॉफ फैक्टर (i) को निम्न प्रकार परिभाषित करते हैं-

प्रश्न 7. असामान्य अणु भार से आप क्या समझते हैं ? असामान्यता लाने वाले कारकों की व्याख्या उदाहरण के साथ करें।
उत्तर⇒ वह पदार्थ जो विलयन में वियोजित होता है, उसका अणुभार सामान्य अणुभार से कम आता है और उस पदार्थ का अणुभार जो विलयन में संगुणित होता है, उसका अणुभार सामान्य से अधिक आता है। इस प्रकार प्राप्त अणुभार असामान्य अणुभार कहलाता है।
CH3COCH3 + Br3 → CH3COCH2Br + HBr
प्रकाश रासायनिक संयोग से हाइड्रोजन व क्लोरीन का हाइड्रोजन क्लोराइड गैस का बनाना शून्य श्रेणी की एक और अभिक्रिया है।
H2 + Cl2![]() 2HCl
2HCl
प्रथम श्रेणी की अभिक्रिया (First order reaction)-जिस अभिक्रिया के वेग में केवल एक अणु की सान्द्रता में परिवर्तन होता है। उदाहरणार्थ,
N2O5 के अपघटन में केवल N2O5 के सान्द्रण पर रासयनिक अभिक्रिया की प्रगति निर्भर होता है।
उदाहरण-N2O5 → 2NO2 + ![]() O2
O2
इसी प्रकार प्लेटिनम की उपस्थिति में H2 O2 के जलीय विलयन का अपघटन, फॉस्फीन का तापीय अपघटन, जलीय विलयन में आमोनियम नाइट्राइट का अपघटन, एसीटोन का अपघटन, प्रोपिऑन एल्डिहाइड का तापीय अपघटन, N – क्लोरो एसीएनिलाइड का पैरा-क्लोरो एसीएनिलाइड में परिवर्तन आदि प्रथम श्रेणी या एकाणुक अभिक्रियाएँ हैं।
H2O2![]() H2O +
H2O + ![]() O2
O2
प्रश्न 8. हेनरी का नियम तथा इसके कुछ महत्वपूर्ण अनुप्रयोग लिखिए।
उत्तर⇒ हेनरी नियम- गैस की विलायक में विलेयता तथा दाब के मध्यम मात्रात्मक संबंध हेनरी ने दिया। हेनरी नियम अनुसार स्थिर ताप पर किसी गैस की द्रव में विलेयता गैस के दाब के समानुपाती होती है।
हेनरी नियम का गणित प्रारूप :
m ∝ P
m = K . P
जहाँ m = घुली गैस का द्रव्यमान
p = साम्यावस्था में दाब
K = हेनरी स्थिरांक
हेनरी नियम के अनप्रयोग-
1. सोडा जल एवं शीतल पेयों में CO2 की विलेयता बढ़ाने के लिए बोतल को अधिक दाब पर बंद किया जाता है।
2. गहरे समुद्र में श्वांस लेने के लिए गोताखोर ऑक्सीजन व हीलियम गैस के मिश्रण का प्रयोग करते हैं। ऐसा करने से उनको पीड़ा का अनुभव नहीं होता।
3. अधिक ऊँचाई वाली जगहों पर ऑक्सीजन का आंशिक दाब सतही स्थानों से कम होता है अतः इन जगहों पर रहने वाले लोगों एवं आरोहकों के रुधिर और ऊतकों में ऑक्सीजन की सांद्रता निम्न हो जाती है। इसके कारण आरोहक कमजोर हो जाते हैं। यह लक्षण ऐनेक्सिया कहलाता है।
प्रश्न 9. समुचित चित्र तथा उपर्युक्त उदाहरण के साथ व्याख्या करें कि क्यों कुछ आदर्श विलयन राउल्ट के नियम में धनात्मक विलयन प्रदर्शित करता है ?
उत्तर⇒ विलयन के दो वाष्पशील घटकों को मिलाने पर अनादर्श विलयन राउल्ट के नियम से धनात्मक विलयन दिखाते हैं, इनके अंतःक्रिया बल का परिणाम घट जाता है अर्थात् A …. B अंतः क्रिया A ….. A तथा B …. B अंतक्रिया से कम होता है। फलस्वरूप प्रत्येक घटक का आंशिक वाष्पदाब तथा विलयन का कुल वाष्पदाब आदर्श विलयन की तुलना में ज्यादा होता है।

आदर्श विलयन के दोनों घटकों व्यवहार खण्डित रेखाओं द्वारा दिखाया गया है और साथ ही सम्पूर्ण विलयन को भी दिखाया गया हैं राउल्ट के नियम का पालन न करने के अतिरिक्त इन विलयनों में निम्न कमियाँ भी होती है-
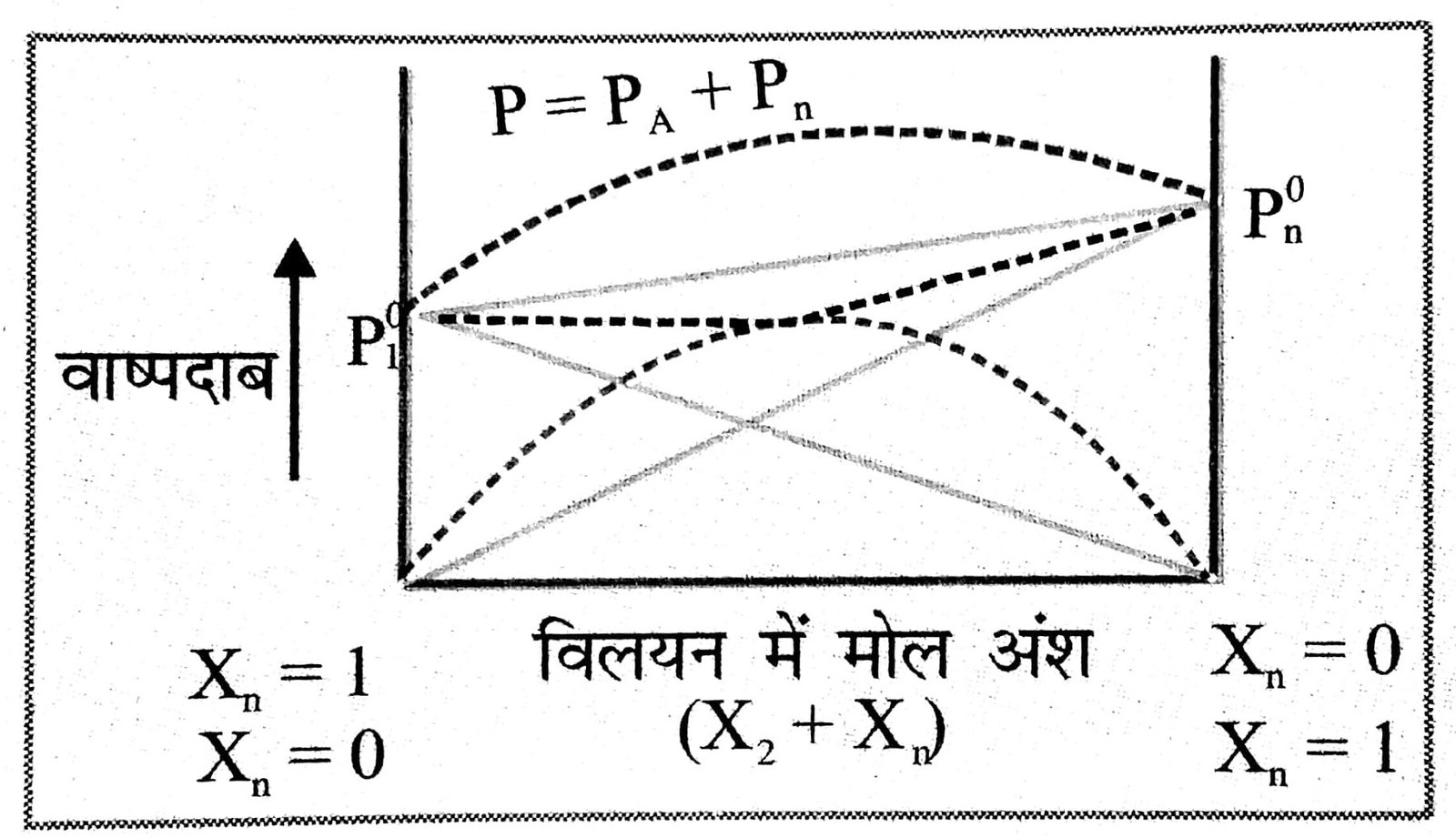 (i) Δv मिश्रण धनात्मक होता है। गैस अनुवानित भी है क्योंकि दुबल अंतःक्रिया बलों के कारण विलयन का आयन बढ़ना निश्चित होता है।
(i) Δv मिश्रण धनात्मक होता है। गैस अनुवानित भी है क्योंकि दुबल अंतःक्रिया बलों के कारण विलयन का आयन बढ़ना निश्चित होता है।
(ii) ΔH मिश्रण धनात्मक होता है विलयन को बनाने के लिए ऊर्जा की जरूरत होती है। क्योंकि विलयन बनाने के लिए विलयन के घटकों को पास-पास लाना होता है इस क्रिया मिश्रण की प्रक्रिया उफष्माशोषी प्रकृति की होती है।
उदाहरण- (i) इथाइल ऐल्कोहल तथा साइक्लोहेक्सेन (ii) ऐसीटोन तथा बेंजीन
प्रश्न 10. कोलॉइडों को निम्न आधार पर कैसे वर्गीकृत किया गया है ?
(क) घटकों की भौतिक अवस्था
(ख) परिक्षेपण माध्यम की प्रकृति
(ग) परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के मध्य अन्योन्यक्रिया ।
उत्तर⇒ (क) परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम की भौतिक अवस्था के आधार पर वर्गीकृत निम्न हैं-
| परिक्षिप्त प्रावस्था | परिक्षेपण माध्यम | कोलॉइड का नाम | उदाहरण प्रकार |
| ठोस | ठोस | ठोस सॉल | कुछ रंगीन कांच एवं रत्न प्रस्तर |
| ठोस | द्रव | सॉल | प्रलेप (पेंट), कोशिका तरल |
| ठोस | गैस | एरोसॉल | धुआँ, धूल |
| द्रव | ठोस | जेल | पनीर, मक्खन, जेली |
| द्रव | द्रव | इमल्शन (पायस) | दूध, बालों की क्रीम |
| द्रव | गैस | एरोसॉल | धुंध, कोहरा, बादल, कीटनाशक स्प्रे |
| द्रव | ठोस | ठोस सॉल | प्यूमिस पत्थर, फोम रबर |
| गैस | द्रव | फोम | फेन, फेंटी गई क्रीम, साबुन के झाग |
(ख) परिक्षेपण माध्यम की प्रकृति के आधार पर
| परिक्षेपण माध्यम | कोलॉइडी सॉल |
| जल | हाइड्रोसॉल |
| एल्कोहल | ऐल्कोसॉल |
| बेंजी | बेंजोसॉल |
| हवा | एरोसॉल |
(ग) परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के मध्य अन्योन्यक्रिया की प्रकृति के आधार पर वर्गीकरण-परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के मध्य अन्योन्यक्रिया की प्रकृति के आधार पर कोलॉइड दो प्रकार के होते हैं- (i) द्रवरागी कोलॉइड (ii) द्रवविरागी कोलॉइड।




