
9. उप-सहसंयोजन यौगिक LONG ANSWER TYPE QUESTIONS
प्रश्न 1. निम्नलिखित उपसहसंयोजन सत्ता में धातुओं के ऑक्सीकरण अंक का उल्लेख कीजिए-
(i) [Co(H2O)(CH)(en)2]2+
(ii) [PtCl4]2-
(iii) [Cr(NH3)3Cl3]
(iv) [CoBr2(en)2]+
(v) K3[Fe(CN)6]
उत्तर⇒ (i) [Co(H2O)(CN)(en)2]2+ यौगिक में H2O अणु उदासीन लिगन्ड है।
x + (-1) = + 2
x = +3
∴ Co की ऑक्सीकरण-संख्या + 3
(ii) [PtCl4]2-Pt की ऑक्सीकरण-संख्या = x
x + 4 (-1) = -2
x = 4 – 2 = +2
∴ Pt की ऑक्सीकरण संख्या = +2
(iii) [Cr(NH3)3Cl3] मे मान Cr की ऑक्सीकरण संख्या x है और NH3 उदासीन लिगन्ड।
∴ x + (-3) = 0
या Cr = +3 (ऑक्सीकरण-संख्या)
(iv) माना Co की ऑक्सीकरण-संख्या = x
[CoBr2(en)2]+
∴ x + 2 (-1) + 3 (1) = +0
x = +3
(v) K3 [Fe(CN)6] में माना Fe की ऑक्सीकरण संख्या = x
∴ x + 6 (-1) + 3(1) = + 0
x = +3
प्रश्न 2. IUPAC नियमों के आधार पर निम्नलिखित के लिये सूत्र लिखिए-
(i) टेट्राहाइड्रोऑक्सोजिंकेट (II)
(ii) पोटैशियम टेट्राक्लोरिडोपैलेडेट (II)
(iii) डाइ-ऐमीनडाइक्लोरिडो प्लैटिनम (II)
(iv) पोटैशियम टेट्रासायनों निकैलेट (II)
(v) पेन्टाऐमीननाइट्रिटो-o-कोबाल्ट (III)
(vi) पेन्टनाऐमीनानाइट्रिटो-N-कोबाल्ट (III).
उत्तर⇒ (i) टेट्राहाइड्रोऑक्सोजिंकेट (II) [Zn(OH)4]2-
(ii) पोटैशियम टेट्राक्लोरिडोपैलेडेट (II)
K2[PdCl4] पोटैशियम टेट्राक्लोरिडोपैलेडेट
(iii) डाइऐमीनडाइक्लोरिडो प्लैटिनम (II)
डाइऐमीनडाइक्लोरिडो प्लैटिनम (II) [PtCl2 (NH3)2]
(iv) पोटैशियम टेट्रासायनों निकैलेट (II)
पोटैशियम टेट्रासायनों निकैलेट (II) K2[Ni(CN)4]
(v) पेन्टाऐमीननाइट्रिटो-o-कोबाल्ट (II)
पेन्टाऐमीननाइट्रिटो-o-कोबाल्ट (II)[Co(ONo) (NH5O)2+
(vi) हैक्साऐमीनकोबाल्ट (III) सल्फेट
हैक्साऐमीनकोबाल्ट (III) सल्फेट [Co(NH3)6]2 (SO4)3
(vii) पोटैशियम ट्राई (ऑक्सैलेटो) क्रोमेट (III)

(viii) हेक्साऐमीन प्लैटिनम (IV) [Pt(NH3)6]+4
(ix) टेट्राब्रोमिडो क्यूप्रेट (II)
टेट्राब्रोमिडो क्यूप्रेट (II) [Cu(Br)4]2-
(x) पेन्टाऐमीनाइट्रिटो-N-कोबाल्ट (III)
पेन्टाऐमीनाइट्रिटो-N-कोबाल्ट (III) [Co(NO2)NH3)5]2+
प्रश्न 3. निम्नलिखित के सभी समावयवों (ज्यामितीय व धुवण) की संरचनाएँ बनाइए-
(i) [CoCl2 (en)2]+
(ii) [Co(NH3)Cl(en)2]2+
(iii) [Co(NH3)Cl2(en)]+
उत्तर⇒ (i) [CoCl2(en)2]+

[Co(NH3)Cl(en)2]2+ की ज्यामिति समावयवता

(ii) [CO(NH3)Cl(en)2]2+

(iii) समपक्ष [CoCl2(en)2] की ध्रुवण समावयव
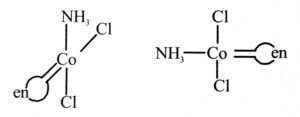
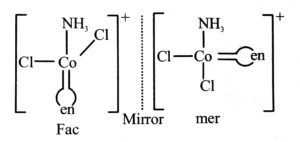
Co(NH3)Cl2(en)]+ समपक्ष और विपक्ष के ज्यामिति समावयव
प्रश्न 4. संयोजकता आबंध सिद्धांत के आधार पर निम्नलिखित उपसहसंयोजन सत्ता में आबंध की प्रकृति की विवेचना कीजिए-
(i) [Fe(CN)6]4+ (ii) [FeF6]3- (iii) [Co(C2O4)3]3- (iv) [CoF6]3-
उत्तर⇒ (i) [Fe(CN)6]4-
CN- लिगन्ड प्रबल है। यह 5d इलेक्ट्रॉन को 3d उपकक्षक में धकेलता है, जिससे इलेक्ट्रॉन अयुग्मित हो जाता है d2sp3 संकरण उत्पन्न करता है।

छ: CN- आयन लिगन्ड छ: इलेक्ट्रॉन युग्म को त्याग कर d2sp3 सकरण कक्षक का निर्माण करते हैं अणु का घूर्णन कम होता है तथा प्रतिचुंबकीय होता है।
(ii) [FeF6]3- हेक्सा फ्लोरो फैरेट (II)
![]()
F- आयन दुर्बल लिगन्ड है। यह इलेक्ट्रॉन को अगले कक्षक में नहीं धकेल सकता। अतः अन्दर के d-उपकक्षक के इलेक्ट्रॉन संकरण में भाग नहीं ले सकते। अतः संकरण में 4d कक्षक का उपयोग होता है। जैसे sp3d2 जो अष्टफलक होता है उच्च घूर्णन यौगिक होता है।


ट्राइऑक्सेलेटो क्रोमेट (III)
कोबाल्ट = CO = 27 = [Ar]3d34s2
COO-
| ऑक्सेलटो प्रबल क्षेत्र उत्पन्न करता है, इस कारण 3d कक्षकों से
COO-
चार इलेक्ट्रॉन को धकेलता है जिससे d2sp3 संकरण उत्पन्न होता है। यह अष्टफलक आकृति उत्पन्न करता है।
∴ अतः यौगिक अनुचुंबकीय है।

अष्टफलकीय आकृति बनाता है।
(iv) [CoF6]3-
[CoF6]3- हेमसाफ्लोरो कोबाल्ट (III) आयन- इस यौगिक में कोबाल्ट की उत्तेजन अवस्था में बाह्य इलेक्ट्रॉन विन्यास 3d6 है अतः F-आयन दुर्बल लिगन्ड है। इसलिए एक 4s, तीन 4p और दो 4d कक्षक संकरण अवस्था में भाग लेकर sp3d2 संकरण कक्षक का निर्माण करते हैं। छ: F-आयन इलेक्ट्रॉन युग्म दान करते हैं। 3d उपकक्षक में इलेक्ट्रॉन युग्म उपसहसंयोजन यौगिक बनाते हैं जो अनुचुंबकीय है।
बाह्य कक्षक के रूप में संयोजक उपकक्षक d का उपयोग किया जाता है। अतः संकरण बाह्य संकरण कहलाता है।
प्रश्न 81. निम्न संकुलों के IUPAC नाम लिखिए तथा ऑक्सीकरण अवस्था, इलेक्ट्रॉनिक विन्यास और उपसहसंयोजन संख्या दर्शाइए। संकुल का त्रिविम रसायन तथा चुंबकीय आघूर्ण भी बताइए :
(i) K[Cr(H2O)2(C2O4)2[.3H2O
(ii) CrCl3(py)3
उत्तर⇒ (i) K[Cr(H2O)2(C2O4)2[.3H2O
पोटैशियम डाइएक्वा डाइऑक्सेलेटो क्रोमेट (III) ट्राइहाइड्रेट CN = 6 ऑक्सीकरण संख्या + 3 इलेक्ट्रॉन विन्यास
Cr+3 = 3d3 [t2g3 – eg2] है।

समपक्ष ध्रुवण समावयवता में d और 1 बनाता है।
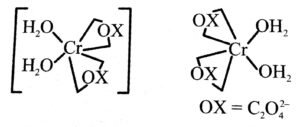
क्योंकि यह तीन अनुग्मित इलेक्ट्रॉन 3d3 रखता है।
अतः μ चुंबकीय =![]()
![]()
(ii) [CrCl3(py)3]
नाम ट्राइक्लोरोट्राइ पाइराइडी क्रोमियम (II)
ऑक्सीकरण संख्या Cr = +3
उपसंहसंयोजन संख्या = 6
इलेक्ट्रॉन विन्यास Cr+3 = 3d3![]()
(a) ज्यमितीय समावयव-
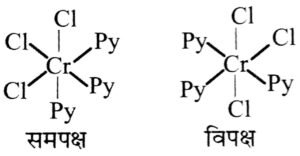
(b) दूसरी प्रकार का ज्यामितीय समावयव फलकीय (Fac) और वामावती समावयव है। चुंबकीय आघूर्णन-इन तीन अयुग्मित इलेक्ट्रॉन रखता है।
μ =![]()
= 3.87 B.M.
प्रश्न 5. संयोजकता आबंध सिद्धांत (VBT) की मुख्य अवधारणाओं का वर्णन करें। चतुष्फलक और अष्टफलक उपसहसंयोजन यौगिकों के उदाहरण दें।
उत्तर⇒ अवधारण- (i) लिगन्ड पर इलेक्ट्रॉन युग्म दान करने के लिए होने चाहिए।
(ii) धातु परमाणु आयन में रिक्त उपकक्षक होने चाहिए।
संयोजकता आबंध सिद्धांत (VBT)-
(i) संयोजकता आबंध सिद्धांत पाउलिंग द्वारा प्रतिपादित है। इस सिद्धांत की मुख्य अवधारण निम्न है। रिक्त उपकक्षक होने चाहिए ताकि उपसहसंयोजी आबंध बन सके।
(ii) कुल आबंध संख्या पर निर्भरता के कारण आवश्यक अपकक्षकों का उपयोग होता है। जैसे-s, p या d, जो संकरण कक्षकों का निर्माण करते हैं।
(iii) संकरण कक्षक आबंध बनाने में उपयोग होते हैं।
(iv) बाह्य उपकक्षक उच्च ध्रुवण या आन्तरिक उपकक्षक निम्न ध्रुवण यौगिक बनाते हैं। यह इस बात पर निर्भर करता है कि किस प्रकार के उपकक्षक उपलब्ध हैं।
उदाहरण- (क) हैक्सा ऐमीन क्रोमियम (III) आयन-इस यौगिक में क्रोमियम आयन की + 3 औक्सीकरण अवस्था है तथा इलेक्ट्रॉन विन्यास 3d3 है।
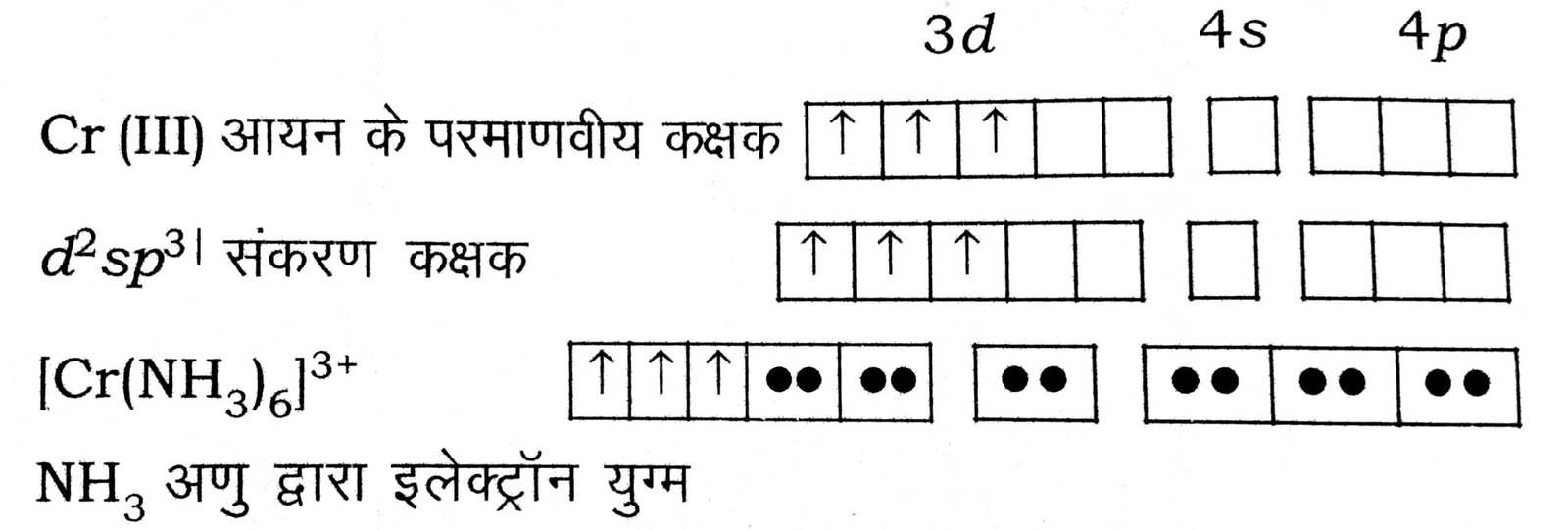
दो 3d, एक 4s तथा तीन 4p कक्षक संकरित होकर d2sp3 संकरण कक्षक का निर्माण करते हैं।
छ: अमोनिया अणु इलेक्ट्रॉन युग्म त्यागकर उपसहसंयोजकी आबध बनाते हैं। अयुग्मित इलेक्ट्रॉन के कारण अनुचुंबकीय हैं।
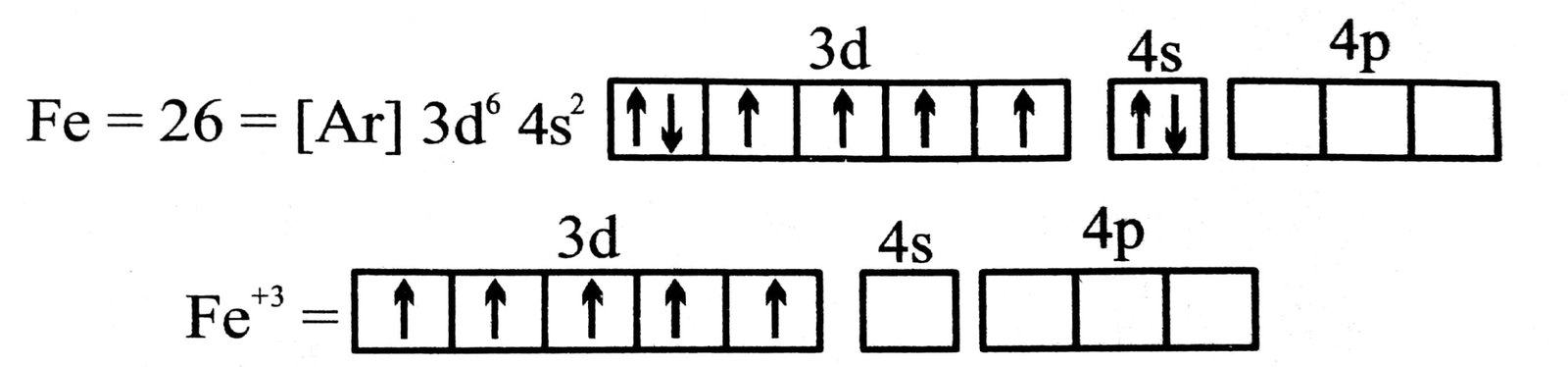
(ख) [Fe(CN)6]3-
आयन- इसमें आयरन आयन की ऑक्सीकरण अवस्था + 3 है।
Fe = [Ar] 3d6 4s2
Fe = [Ar] 3d5 4s0
फेरिक आयन में छ: उपकक्षक रिक्त रहता है जो सायनाइड आयन द्वारा त्यागे गए छ: इलेक्ट्रॉन युग्मों को ग्रहण करता है। ऐसा निम्न योजना अनुसार होता है-

एक इलेक्ट्रॉन अयुग्मित है। अतः अनुचुंबकीय है तथा अष्टफलक आकृति का निर्माण करता है।
(ग) [Fe(CN)6]4-
आयन-इस उपसहसंयोजक यौगिक आयन में आयरन की ऑक्सीकरण अवस्था + 2 है।
Fe परमाणु का इलेक्ट्रॉन विन्यास [Ar] 3d6 4s2
Fe+2 आयन का इलेक्ट्रॉन विन्यास [Ar] 3d6
सायनाइड आयन से छ: युग्म इलेक्ट्रॉन प्राप्त करने के लिए आयरन आयन छ: रिक्त उपकक्षक प्रदान करता है। यह d2sp3 संकरण द्वारा संभव है। CN- आयन प्रबल लिगन्ड है जो इलेक्ट्रॉन को युग्मित करता है।
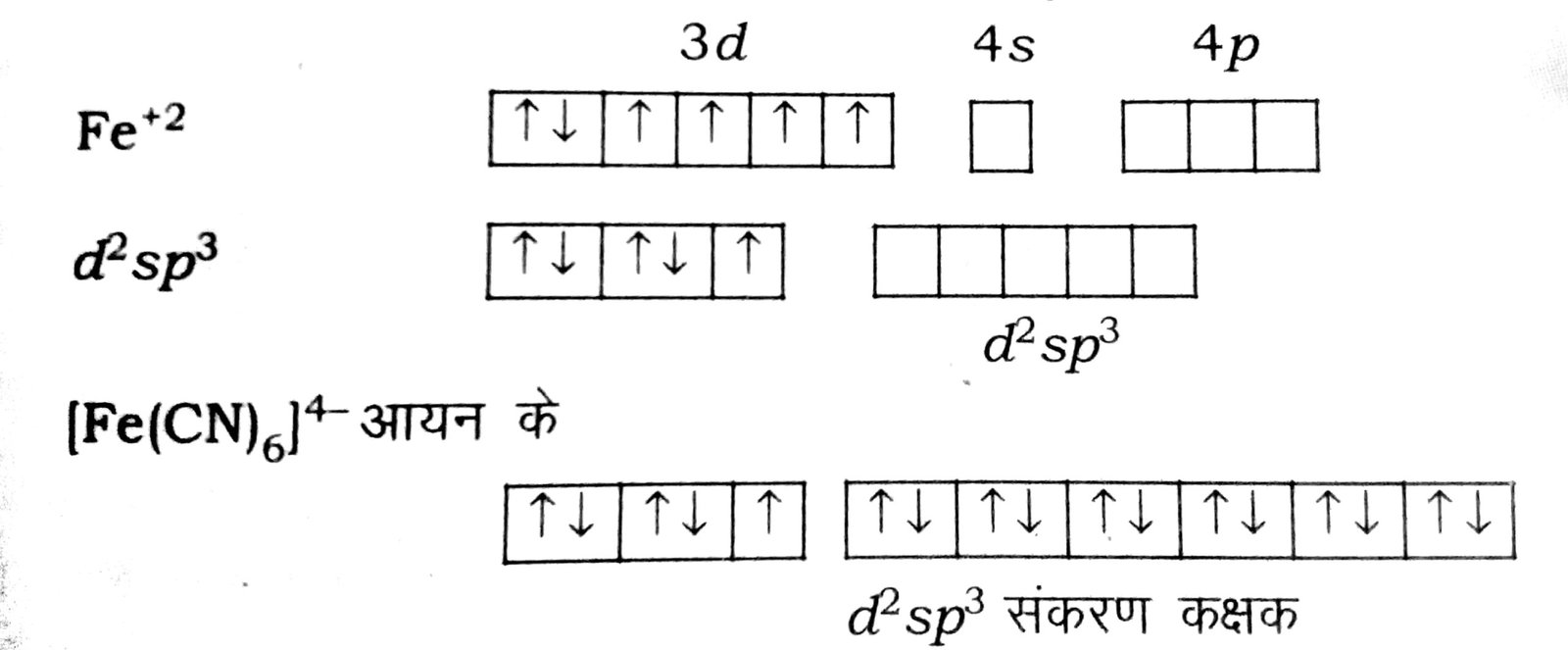
अतः छ: सायनाइड CN-आयन से छ: इलेक्ट्रॉन युग्म रिक्त d2sp3 के छ: संकरित कक्षकों में जगह बनाते हैं। क्योंकि एक इलेक्ट्रॉन अयुग्मित है, अतः यह प्रति-चुंबकीय है।
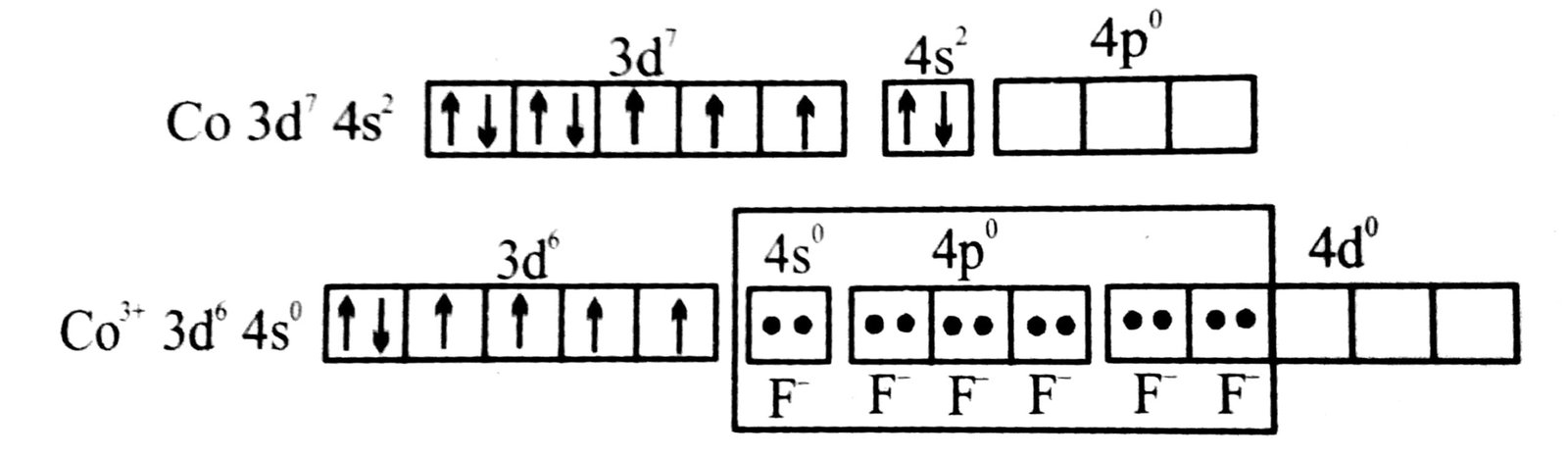
(घ) [CoF6]-3
आयन- इस उपसहसंयोजक यौगिक आयन में कोबाल्ट की ऑक्सीकरण अवस्था + 3 है।
Co का इलेक्ट्रॉन विन्यास = [Ar] 3d7 4s2
Co+3 आयन = [Ar] 3d6
कोबाल्ट (III) आयन में छ: रिक्त उपकक्षक हैं जो छः फ्लुराइड लिगन्ड से इलेक्ट्रॉन युग्म प्राप्त कर sp3d2 संरचण दर्शाते हैं।

अतः छः फ्लोराइड आयन से छ: इलेक्ट्रॉन युग्म प्राप्त कर sp3d2 कक्षक में भरे जाते हैं। 3d उपकक्षक में इलेक्ट्रॉन युग्मों को रिक्त उपकक्षक में भरते हैं।
(ड) [Ni(CO)4]– इसी यौगिक में निकेल की ऑक्सीकरण अवस्था शून्य है। शून्य ऑक्सीकरण अवस्था में निकेल का इलेक्ट्रॉन विन्यास [Ar] 3d8 4s2 है। अतः कार्बोनाइल द्वारा प्रदान चार इलेक्ट्रॉन युग्मों को रिक्त उपकक्षक में भरते हैं।
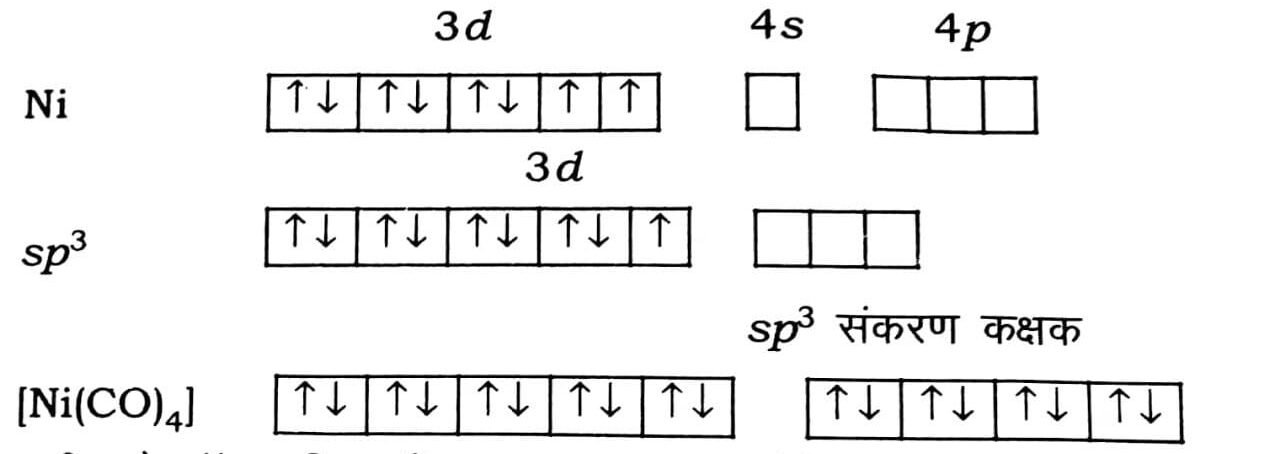
सभी इलेक्ट्रॉन युम्मित हैं, अतः [Ni(CO)4] यौगिक प्रतिचुंबकीय है।
(च) [Ni(CN)4]-2– टैट्रा सायनो निकैलेट (II)-सायनाइड प्रबल लिगन्ड है जो इलेक्ट्रॉन को युग्मित करता है तथा dsp3 संकरण कक्षक बनाता है।

प्रश्न 6. (i) अम्लराज और सधूम नाइट्रिक अम्ल क्या है ?
(ii) अमोनिया गैस को शुष्क बनाने के लिए किस शुष्क कारण का प्रयोग किया जाता है और क्यों ?
उत्तर⇒ (i) अम्लराज (Aqua regia)-आयतन के विचार से तीन भाग सांद्र हाइड्रोक्लोरिक अम्ल (HCl) एवं एक भाग सांद्र नाइट्रिक अम्ल (HNO3) के मिश्रण को अम्लराज कहा जाता है। अम्लराज अत्यंत शक्तिशाली (Very strong) अम्ल होता है। इसमें सोना, प्लैटिनम आदि जैसे अत्यंत अक्रियाशील धातुओं को भी घुला लेने की क्षमता होती है। अम्लराज की सक्रियता HNO3 और HCl की प्रतिक्रिया के परिणामस्वरूप बने नवजात क्लोरीन परमाणु के कारण होता है।

सधूम नाइट्रिक अम्ल (Fuming nitric acid)-सांद्र नाइट्रिक अम्ल जिसमें NO2 गैस अधिकता में घुला रहता है। सधूम नाइट्रिक अम्ल कहलाता है। घुली हुई NO2 गैस इसमें भूरे धूम (brown fume) के रूप में निकलती रहती है। इसी कारण इसे सधूम नाइट्रिक अम्ल कहा जाता है। इसे प्राप्त करने के लिए सांद्र नाइट्रिक अम्ल में थोड़ा स्टार्च मिलाकर मिश्रण का स्त्रवण किया जाता है। सधूम नाइट्रिक अम्ल, सांद्र नाइट्रिक अम्ल की अपेक्षा अधिक प्रबल ऑक्सीकारक है।
(ii) अमोनिया गैस को शुष्क बनाने के लिए इसे कली चूना (CaO) से होकर प्रवाहित किया जाता है। कली चूना अमोनिया गैस में उपस्थित जलवाष्प को शोषित करके भखरा चूना में बदल जाती है।
CaO + H2O → Ca(OH)2
अमोनिया को अन्य प्रचलित शुष्क कारकों जैसे-अनार्द्र CaCl2 P2O5 या सांद्र H2 SO4 द्वारा शुष्क नहीं बनाया जा सकता क्योंकि ये पदार्थ अमोनिया के साथ निम्नलिखित तरीके से प्रतिक्रिया कर लेते हैं-
CaCl2 + 8NH3 = CaCl2 . 8NH3
2NH3 + H2SO4 = (NH4)2 SO4
P2O5 + 6NH3 + 3H2O = 2(NH4)3PO4
प्रश्न 7. संक्रमण धातुएँ रंगीन यौगिक का निर्माण करते हैं। विवेचन करें।
उत्तर⇒ यौगिक के रंग (Colour of compound)-संक्रमण धातु रंगीन यौगिक का निर्माण करने में सक्षम हैं। उदाहरणार्थ, FeCl3, CoCl2, CuSO4, CdS रंगीन होते हैं। रंग की व्याख्या d – d संक्रमण (d – d transition) एवं आवेश स्थानान्तरण (charge transfer) के आधार पर की जाती है।
(i) d – d संक्रमण (d – d transition)- d सब ऑरबिट में पाँच ऑरबिटल (dxy, dxz, dyz, dx2 –y2 एवं dz2) होते हैं। स्वतंत्र अवस्था में पाँचों ऑर्बिटलों की ऊर्जा बराबर होती है, लेकिन यौगिक में d – ऑर्बिटलों के दो सेट t2g (dxy, dxz, dyz) एवं eg (dx2 – y2 एवं dz2) प्राप्त होते हैं।
ष्टफलकीय (Octachedral) यौगिक में d – ऑर्बिटल का विघटन (splitting) निम्न प्रकार से होता है-

चतुष्फलकीय यौगिकों में d-orbital का विघटन (splitting) निम्न प्रकार से होता है-

यौगिक में भी इलेक्ट्रॉन कम ऊर्जा वाले ऑरबिटल में रहता है। लेकिन जब यौगिक से होकर दृश्य प्रकाश (visible light) की किरणें गुजरती हैं तो दृश्य प्रकाश के अवयवी रंगों जिसकी ऊर्जा t2 एवं e ऑर्बिटलों की ऊर्जा के अन्तर के बराबर होती है, यौगिक के द्वारा शोषित हो जाती हैं फलस्वरूप यौगिक से निकलने वाली किरणपूंज में उस रंग की किरण का अभाव हो जाता है। यह किरण रंगीन हो जाती है। इसी कारण से यौगिक रंगीन दिखाई पड़ने लगता है। उदाहरणार्थ यदि कोई यौगिक नीले रंग की किरण को शोषित कर लेता है, तो निकलनेवाली किरण में रंग लाल दिखाई पड़ेगा। ऐसे यौगिकों के रंगीन होने के कारण नीचे के ऑर्बिटल से ऊपर के ऑर्बिटल में इलेक्ट्रॉन के स्थानान्तरण को d – d संक्रमण (d – d transition) कहा जाता है।
चतुष्फलकीय यौगिक में d– ऑर्बिटल षटफलकीय यौगिकों के विपरीत होती है अर्थात् t2le ऑर्बिटल की ऊर्जा e ऑर्बिटल से अधिक होती है। अतः इन यौगिकों में d – d संक्रमण के फलस्वरूप इलेक्ट्रॉन का स्थानान्तरण e से t2 ऑर्बिटल में होता है।
d – d संक्रमण के फलस्वरूप उत्पन्न रंग हल्के (light) होते हैं।
आवेश स्थानान्तरण (Charge transfer)-संक्रमण तत्वों के कुछ ऐसे यौगिक भी पाये जाते हैं जिनमें d संक्रमण नहीं होने के बावजूद भी गाढ़े (intense) रंग होते हैं। इस तथ्य की व्याख्या आवेश स्थानान्तरण के आधार पर की जाती है। ऐसे यौगिक का अवयवी धनायन यौगिक के अवयवी ऋणायन द्वारा प्रदत्त इलेक्ट्रॉन को ग्रहण कर सकता है। ऐसा यौगिक प्रकाश के किसी रंग की किरणों को शोषित कर अवकारक के एक इलेक्टॉन को ऑक्सीकारक पर स्थानान्तरित करता है।
उदाहरण- पोटाशियम परमैग्नेट (KMnO4) तथा पोटाशियम डाइको (K2Cr2O7) के रंगीन होने का कारण आवेश स्थानान्तरण ही है।
![]()
प्रश्न 8. कारण बताएँ-
(a) साइनाइड कॉम्प्लेक्स {Ag(CN)2} से सिल्वर धातु के निष्कर्षण में जिंक इस्तेमाल करते हैं परन्तु कॉपर नहीं, क्यों ?
(b) क्यों कैल्शियम ऑक्साइड सिलिका के साथ धातुमल बनाता है ?
(c) क्यों कैल्शिनेशन में कभी-कभी सल्फेट का बनना उपयोगी होता है ?
उत्तर⇒ (a) जिंक की विद्युत धनात्मक Cu से ज्यादा है। इसलिए सायनाइड कम्प्लेक्स से सिल्वर के निष्कर्षण में जिंक का इस्तेमाल करते हैं।
(b) CaO + SiO2→ CaSiO3
कैल्शियम ऑक्साइड भस्मीय फ्लक्स है जबकि SiO2 अशुद्धि है। इसलिए कैल्शियम ऑक्साइड सिलिका के साथ धातुमल बनाते हैं।
(c) कैल्शिनेशन में सल्फेट बनने से वह दूसरे धातु के साथ ऑक्सीकृत नहीं होता है जिससे धातु की मात्रा में कमी नहीं होती है।
प्रश्न 9. उपसहसंयोजन यौगिकों के लिए संभावित विभिन्न प्रकार की समावयवताओं को सूचिबद्ध कीजिए तथा प्रत्येक का एक उदाहरण दीजिए।
उत्तर⇒ उपसहसंयोजन यौगिकों में दो प्रकार की समावयवताएँ ज्ञात हैं
(i) त्रिविम समावयता,
(ii) संरचनात्मक समावयवता।
(i) त्रिविम समावयता-त्रिविमीय समावयवों के रासायनिक सूत्र व रासायनिक आबंध समान होते हैं। त्रिविम समावयव दो प्रकार के होते हैं
(i) ज्यामितीय समावयवता,
(ii) ध्रुवण समावयवता।
(i) ज्यामितीय समावयता-इस प्रकार की समावयता हेट्रोलेप्टिक संकुलों में पाई जाती है जिनमें लिगेन्डों की भिन्न ज्यामितीय व्यवस्थाएँ संभव हो सकती हैं। इस प्रकार के व्यवहार के प्रमुख उदाहरण 4 व 6 उपसहसंयोजन संख्या वाले संकुलों में पाए जाते हैं। इस प्रकार की समावयवता चतुष्फलकीय ज्यामिति में संभव नहीं है परन्तु [MX2L4] सूत्र वाले अष्टफलकीय संकुलों में जहाँ दो लिगेन्ड X एक-दूसरे के समपक्ष या विपक्ष हो संभव है।

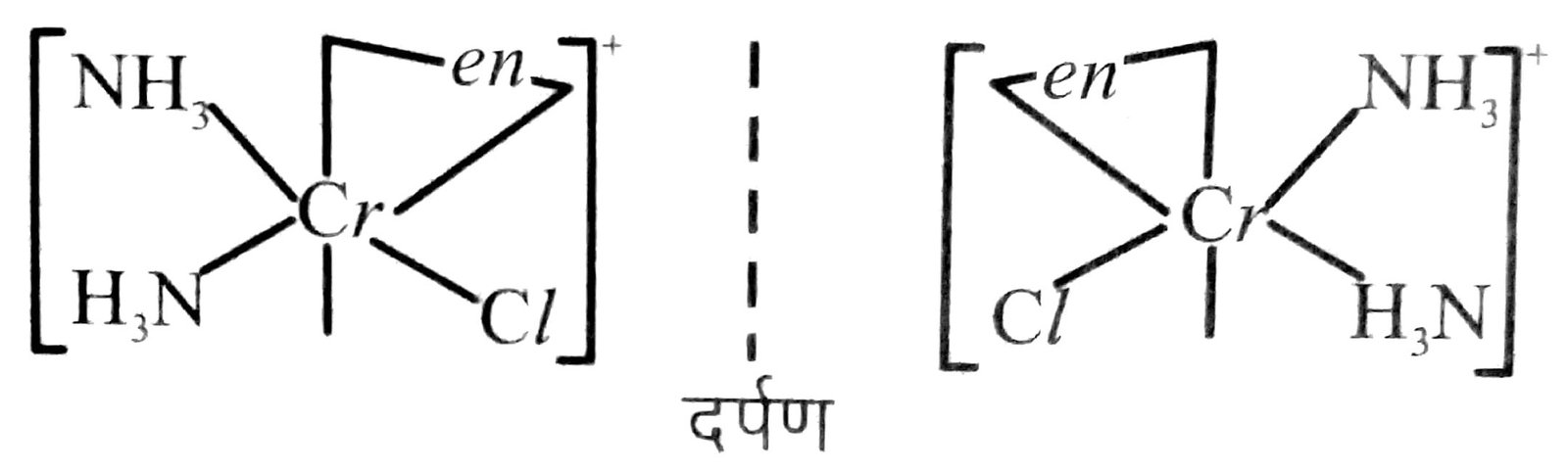
(ii) धुवण समावयता-ध्रुवण समवयव एक-दूसरे के दर्पण प्रतिबिब होते हैं जिन्हें एक-दूसरे पर अध्यारोपित नहीं किया जा सकता। इन्हें प्रतिबिंब रूप या एनैन्टिओमर कहते हैं। अणु अथवा आयन जो एक-दूसरे पर अध्यारोपित नहीं किए जा सकते, काइरल कहलाते हैं। ये दो रूप दक्षिण-ध्रुवण घूर्णक (d) और वामावर्ती (1) कहलाती हैं, यह इस बात पर निर्भर करता है कि ये ध्रुवणमापी में समतल ध्रुवित प्रकाश को किस दिशा में घूर्णित करते हैं (d दाई तरफ घूर्णित करता है तथा I बाईं तरफ) प्रकाशिक समावयवता सामान्य रूप से द्विदंतूर लिगेन्ड युक्त अष्टफलकीय संकुलों में पाई जाती है। जैसे-[Pt Cl2 (en)2]2+ के समान उपसहसंयोजक समूह में केवल समपक्ष रूप प्रकाशित समावयवता दर्शाता है।
(i) बंधनी समावयवता-
[Co(NH3)5 NO2] Cl2 और (Co(NH3)5 (ONo)Cl2
पीला रंग लाल रंग
(ii) उपसहसंयोजन समावयवता-
[Co(NH3)6] [Cr (CN)6] और (Cr(NH3)6] [Co(CN)6]
(iii) आयन समावयवता-
[Co(NH3)5 SO4 Br और [Co(NH3)5 Br]SO4
(iv) विलायकयोजन समावयवता-
[Cr(H2O)5 Cl] Cl2H2O हरा रंग उत्पन्न करता है।
प्रश्न 10. प्रत्येक का एक उदाहरण देते हुए निम्नलिखित में उपसहसंयोजन यौगिकों की भूमिका की संक्षिप्त विवेचना कीजिए
(i) जैव प्रणालियाँ
(ii) औषध रसायन
(iii) विश्लेषणात्मक रसायन
(iv) धातुओं का निष्कर्षण/धातु कर्म
उत्तर⇒ (i) जैव तंत्र में उपसहसंयोजन यौगिकों का महत्व-प्रकाश संश्लेषण के लिए उत्तरदायी वर्णक, क्लोरोफिल, मैग्नीशियम का उपसहसंयोजन यौगिक है। रक्त का लाल वर्णक हीमोग्लोबिन, जोकि ऑक्सीजन का वाहक है, आयरन का एक उपसहसंयोजन यौगिक है। विटामिन B12 सायनोकोबालऐमीन, प्रतिप्रणाली अरक्तता कारक, कोबाल्ट का एक उपसहसंयोजन यौगिक है। जैविक महत्व के अन्य आयन युक्त उपसहसंयोजन यौगिक जैसे-कार्बोक्सी पेप्टिडेज-A तथा कार्बनिक एनहाइड्रेज एन्जाइम हैं।
(ii) औषध रसायन में उपयोग- औषध रसायन में कीलेट चिकित्सा के उपयोग में अभिरुचि बढ़ रही है। इसका एक उदाहरण है-पौधे/जीव जंतु निकायों में विषैले अनुपात में विद्यमान धातुओं के द्वारा उत्पन्न समस्याओं का उपचार। इस प्रकार कॉपर तथा आयरन की अधिकता को D-पेनिसिलऐमीन तथा डेसफेरीआक्सिम B लिगेन्डों के साथ उपसहसंयोजन यौगिक बनाकर दूर किया जाता है। EDTA को लेड की विषाक्ता के उपचार में प्रयुक्त किया जाता है। प्लेटिनम के कुछ उपसहसंयोजन यौगिक ट्यूमर वृद्धि को प्रभावी रूप से रोकते हैं। उदाहरण-समपक्ष प्लेटिन तथा संबंधित यौगिक।
(iii) गुणात्मक तथा मात्रात्मक रासायनिक विश्लेषण में उपयोग-उपसहसंयोजन यौगिकों के गुणात्मक व मात्रात्मक रासायनिक विश्लेषणों में बहुत उपयोग है। अनेक परिचित रंगीन अभिक्रियाएँ जिनमें धातु आयनों के साथ अनेक लिगेन्डों की उपसहसंयोजन सत्ता बनने के कारण रंग उत्पन्न होता है। चिरसम्मत तथा यांत्रिक विधियों द्वारा धातु आयनों की पहचान व उनके मात्रात्मक आकलन का आधार है। ऐसे अभिकर्मकों के उदाहरण हैं-EDTA, DMG, ∝ – नाइट्रोसो-β नेपथॉल, क्यूपरॉन आदि।
(iv) धातु निष्कर्षण में-धातुओं की प्रमुख निष्कर्ष विधियों में जैसे सिल्वर तथा गोल्ड के लिए संकुल विरचन का उपयोग होता है। उदाहरणार्थ, ऑक्सीजन तथा जल की उपस्थिति में गोल्ड, सायनाइड आयन से संयोजित होकर जलय विलयन में सहसंयोजन सत्ता [Au(CN)2]– बनाता है। इस विलयन में जिंक मिलाकर गोल्ड को पृथक किया जा सकता है।




