12. परमाणु ( Short Answer Type Question )
Q.1. रदरफोर्ड के परमाणु मॉडल की क्या सीमाएँ हैं ?
Ans ⇒ रदरफोर्ड के परमाणु मॉडल की निम्नलिखित सीमाएँ हैं –
(a) नाभिक के चारों तरफ परिभ्रमण करते हुए इलेक्ट्रॉन नाभिक के केन्द्र की तरफ लगातार त्वरित होता है। लॉरेन्ज के अनुसार त्वरित आवेशित कण को लगातार ऊर्जा विकीर्णित करना चाहिए। इसलिए, परमाणु में भी, परिभ्रमण करते हुए इलेक्ट्रॉन को लगातार ऊर्जा उत्सर्जित करनी चाहिए और इस तरह उसके पथ की त्रिज्या घटते जाना चाहिए तथा अन्त में चित्रानुसार उसे नाभिक पर गिर जाना चाहिए। इसलिए रदरफोर्ड के परमाणु मॉडल परमाणु के स्थायित्व की व्याख्या नहीं करता है।
(b) यदि रदरफोर्ड के मॉडल सत्य हैं तो इलेक्ट्रॉन सभी संभव त्रिज्याओं के कक्षाओं में परिभ्रमण कर सकते हैं तथा इसलिए उसे लगातार ऊर्जा स्पेक्ट्रम उत्सर्जित करना चहिए। यद्यपि परमाणु हाइड्रोजन की तरह रेखीय स्पेक्ट्रम होते हैं।
Q. 2. हाइड्रोजन परमाणु मॉडल के लिए बोर की क्या मान्यताएँ या परिकल्पनाएँ हैं ?
Ans ⇒ बोर के हाइड्रोजन परमाणु मॉडल की निम्नलिखित मान्यताएँ या परिकल्पनाएँ हैं :
(a) परमाणु जिसमें धनावेशित नाभिक होता है परमाणु के पूरे द्रव्यमान के लिए उत्तरदायी होता है।
(b) इलेक्ट्रॉन निश्चित त्रिज्याओं के किसी निश्चित वृत्ताकार कक्षाओं में नाभिक के चारों तरफ परिभ्रमण करता है।
(c) निश्चित कक्षाएँ वैसे होते हैं जिसमें इलेक्ट्रॉन के कोणीय संवेग h/2π के पूर्ण गुणज होते हैं, जहाँ h प्लांक का स्थिरांक है। इसका मान 6.62 x 10-34 जूल-सेकेण्ड है।
माना कि m तथा v, त्रिज्या r के निश्चित कक्षाओं में इलेक्ट्रॉन के द्रव्यमान, रैखिक वेग तथा उसके घूर्णन त्रिज्या है, तो ![]() , जहाँ n प्रधान क्वांटम संख्या कहलाती है, जिसका पूर्ण मान क्रमशः 1, 2, 3,…………है।
, जहाँ n प्रधान क्वांटम संख्या कहलाती है, जिसका पूर्ण मान क्रमशः 1, 2, 3,…………है।
यह बोर का क्वांटाइजेशन अवस्था कहलाती है।
(d) जब इलेक्ट्रॉन, निश्चित कक्षाओं में परिक्रमा करते हैं तो वे ऊर्जा विकीर्णन नहीं करते हैं तथा वैसे कक्षाओं को स्थायी कक्षाएँ कहते हैं।
(e) ऊर्जा विकीर्णित होती है, जब इलेक्ट्रॉन उच्च ऊर्जा कक्षा से निम्न ऊर्जा कक्षा पर कूदती है तथा ऊर्जा अवशोषित होती है जब वह निम्न ऊर्जा कक्षा से उच्च ऊर्जा कक्षा पर कूदती है।
माना कि ni तथा nf प्रधान क्वांटम संख्या के कक्षाओं के साथ क्रमशः E1 तथा Ef ऊर्जाओं से सम्बन्धित है। इसमें ni < nf तो उत्सर्जित विकिरण की आवृत्ति ![]() है। यह बोर की आवृत्ति अवस्था कहलाती है, जहाँ h प्लांक नियतांक है।
है। यह बोर की आवृत्ति अवस्था कहलाती है, जहाँ h प्लांक नियतांक है।
Q. 3. α-किरणों के प्रकीर्णन के प्रयोग में अधिकांश α-कण धातु-पत्र से होकर सीधे गुजर जाते हैं। इससे आप क्या निष्कर्ष निकालेंगे ?
अथवा, रदरफोर्ड के α-कणों के प्रकीर्णन से क्या निष्कर्ष निकाला गया ?
Ans ⇒ धातु-पत्र (धातु की पत्ती) पर से α-कणों के प्रकीर्णन में यह देखा गया कि ये कण विभिन्न दिशाओं में विक्षेपित हो जाते हैं। प्रयोग में यह भी देखा गया कि अधिकांश α-कणों में कोई भी विक्षेप नहीं होता। कुछ कण तो छोटे-छोटे कोणों से विक्षेपित होते हैं, परंतु कुछ ही कण अपने प्रारंभिक पथ से 90° से भी अधिक कोण से विक्षेपित हो जाते हैं। जब धन आवेश से आविष्ट α-कण धातु-पत्र के परमाणु से गुजरते हैं तो उनमें से अधिकांश कणों पर कोई बल नहीं लगता या बहुत कम बल लगता है। परंतु किसी-किसी कण पर बहुत अधिक विकर्षण-बल लगता है। रदरफोर्ड ने अनुमान लगाया कि ऐसा तभी संभव है जब परमाणु के अंदर एक धन आवेश अत्यधिक संकेंद्रित (concentrated) हो। गणना के आधार पर उन्होंने बताया कि परमाणु में उसका द्रव्यमान तथा धन आवेश अत्यंत छोटे आकार (10-15m त्रिज्या) के नाभिक (न्यूक्लियस) में संकेंद्रित रहते हैं तथा इलेक्ट्रॉन नाभिक के चारों ओर वृत्तीय कक्षाओं (circular orbits) में घूमते रहते हैं। इस प्रकार परमाणु के अंदर नाभिक तथा इलेक्ट्रॉनों के बीच स्थान खाली रहता है। यदि α-कण परमाणु के खोखले भाग से गुजरते हैं तो वे सीधे अथवा थोड़ा विक्षेपित होकर निकल जाते हैं। यदि -कण नाभिक के बहुत निकट से गुजरता है तो वह तीव्र विकर्षण बल का अनुभव करता है और अपने पथ से अधकि विक्षेपित हो जाता है।
Q.4. रिडवर्ग नियतांक क्या है, इसका मात्रक लिखें।
Ans ⇒ हाइड्रोजन परमाणु के बोर-सिद्धांत (Bohr’s theory) से हम जानते हैं कि जब इलेक्ट्रॉन उच्चतर कक्षा (higher orbit) n2 (ऊर्जा n2‘) से निम्नतर कक्षा (lower orbit) n1(ऊर्जा En1) में आता है तब विद्युत-चंबकीय तरंगों के रूप में उत्सर्जित फोटॉन की ऊर्जा

यदि प्रकाश का वेग c हो और उत्सर्जित विकिरण ऊर्जा का तरंगदैर्ध्य λ हो, तो
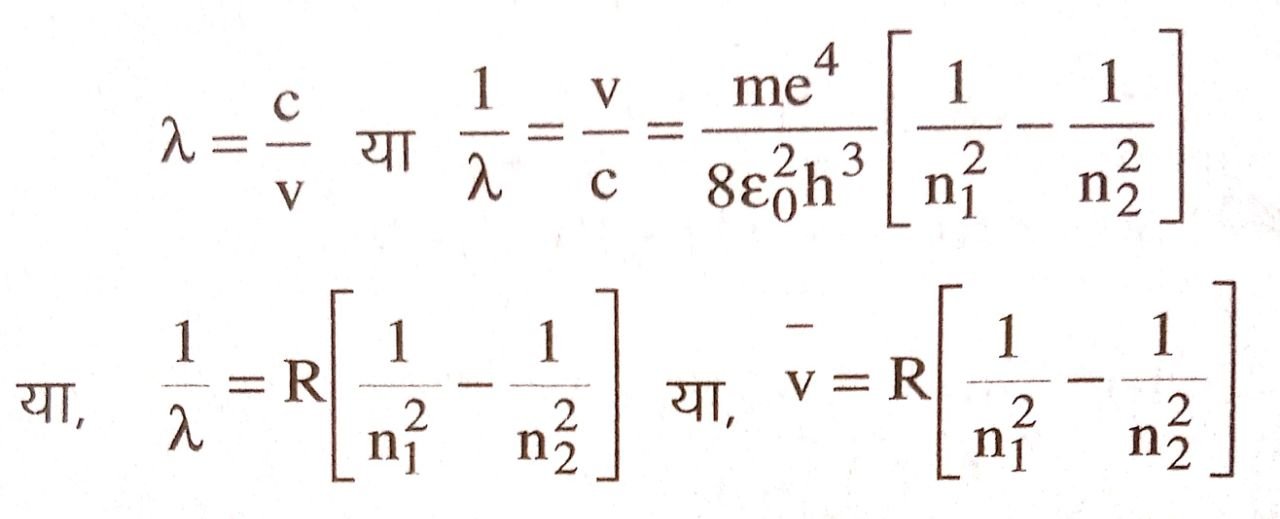
जहाँ 1/λ = ![]() ;
;![]() को उत्सर्जित विकिरण-ऊर्जा की तरंग संख्या (wave number) कहा जाता है , तथा R =
को उत्सर्जित विकिरण-ऊर्जा की तरंग संख्या (wave number) कहा जाता है , तथा R = ![]() ‘ एक नियतांक है जिसे रिडबर्ग
‘ एक नियतांक है जिसे रिडबर्ग
नियतांक (Rydberg constant) कहा जाता है। उपर्युक्त व्यंजक में m इलेक्ट्रॉन का द्रव्यमान, e इलेक्ट्रॉन पर आवेश, ε0 मुक्त आकाश की परावैद्युतता (permitivity of free space), c प्रकाश का वेग तथा h प्लांक का स्थिरांक है।
रिडबर्ग नियतांक का SI मात्रक m-1 है तथा इसका सैद्धांतिक मानक 1.097000 x 107m-1 प्राप्त होता है।
रिडबर्ग नियतांक का यह सैद्धांतिक मान, प्रयोगात्मक मान से बहुत ही थोड़ा भिन्न है।
Q.5. उत्तेजित ऊर्जा तथा आयनीकरण ऊर्जा से आप क्या समझते हैं ?
अथवा, उत्तेजित तथा आयनीकरण ऊर्जा क्या है ?
Ans ⇒ उत्तेजित ऊर्जा – उत्तेजित ऊर्जा, ऊर्जा का वह परिमाण है जो एक इलेक्ट्रॉन को ग्राउंड अवस्था से परमाणु के किसी एक उत्तेजित अवस्था में कूदने में लगता है।
हम जानते हैं कि हाइड्रोजन परमाणु के ग्राउंड अवस्था (n = 1) में इलेक्ट्रॉन की ऊर्जा, E1 = 13.6 3V, प्रथम उत्तेजित अवस्था में (n = 2) में इलेक्ट्रॉन की ऊर्जा E2 = -3.4 eV है।
इसलिए, हाइड्रोजन परमाणु के प्रथम उत्तेजित ऊर्जा,
E2 – E1 = – 3.4 – (- 13.6) = 10.2 eV.
अतः 10.2 वोल्ट को प्रथम उत्तेजित विभव कहते हैं। उसी प्रकार, हाइड्रोजन परमाणु के दूसरे उत्तेजित ऊर्जा, E3 – E1 = -1.51 – (-13.6) = 12.09 eV तथा दूसरे उत्तेजित विभव 12.09 वोल्ट है।
आयनीकरण ऊर्जा – आयनीकरण ऊर्जा वैसी आवश्यक ऊर्जा है, जिसके परमाणु से एक इलेक्ट्रॉन को बाहर निकाला जाता है। जब इलेक्ट्रॉन को बढ़ाकर कक्षा n = ∞ में ले जाया जाता है तो वह परमाणु से पूर्णतः बाहर हो जाता है। इसलिए, हाइड्रोजन परमाणु के आयनीकरण ऊर्जा n = 1 कक्षा से n = ∞ कक्षा में छोड़ने में आवश्यक ऊर्जा के बराबर होता है। अर्थात् आयनीकरण ऊर्जा = E∞ – E1 = 0 – (- 13.6) = 13.6 ev । अतः हाइड्रोजन परमाणु के आयनीकरण विभव 13.6 वोल्ट है।
Q.6. नाभिक का संघटन क्या है ? समझाएँ।
Ans ⇒ परमाणु के नाभिक में प्रोटॉन तथा न्यूट्रॉन होते हैं। प्रोटॉन और न्यूट्रॉनों की कुल संख्या मिलकर परमाणु की द्रव्यमान संख्या या उसके परमाणु भार A के बराबर होती है तथा प्रोटॉनों की संख्या, परमाणु क्रमांक Z के बराबर होती है। नाभिक का कुल आवेश उसमें उपस्थित समस्त प्रोटॉनों के आवेश के बराबर होता है तथा नाभिक का कुल द्रव्यमान, उसमें उपस्थित समस्त प्रोटॉनों एवं न्यूट्रॉनों के द्रव्यमान के योग के बराबर होता है। उदाहरण के लिए, हाइड्रोजन (परमाणु क्रमांक = 1, परमाणु भार = 1) के नाभिक में केवल एक प्रोटॉन होता है। हीलियम का परमाणु क्रमांक 2 तथा परमाणु भार 4 है, अतः इसके नाभिक में दो प्रोटॉन तथा दो न्यूट्रॉन होते हैं।
किसी भी नाभिक में प्रोटॉनों की संख्या ठीक उतनी ही होती है जितना उस तत्त्व का परमाणु क्रमांक होता है तथा न्यूट्रॉनों की संख्या = परमाणु भार – परमाणु क्रमांक।
नाभिक के संघटन की यह प्रोटॉन- न्यूट्रॉन परिकल्पना अनेक प्रयोगों द्वारा प्रमाणित की जा चुकी है तथा इसी परिकल्पना को अभी तक सत्य माना जाता है।
Q.7. रदरफोर्ड के-कण प्रकीर्णन के प्रायोगिक निरीक्षण का क्या निष्कर्ष प्राप्त हुआ ?
Ans ⇒ निष्कर्ष –
(i) परमाणु के सभी धनात्मक आवेश अत्यल्प भाग में संकेन्द्रित होते है।
(ii) पूरे द्रव्यमान थोड़े भाग में ही संकेन्द्रित होते हैं, जिनका आकार का भाग 1/10000 वाँ भाग होता है उसे नाभिक कहा जाता है।

(iii) नाभिक के चारों ओर का स्थान व्यावहारिक रूप से रिक्त होता है। सोने के नाभिक प्रकीर्णित प्रक्रिया में स्थिर होते हैं।
α- कण का परिणाम F = ![]()
(iv) α-कणों के प्रकीर्णन की कुल संख्या तथा प्रकीर्णन कोण के बीच का ग्राफ परमाणु के नाभिक मॉडल के आधार पर होता है।
Q. 8. समीपस्थ पहुँच दूरी (क्लोजेस्ट एप्रोच दूरी) क्या है ? समझाएँ।
Ans ⇒ α-कण प्रकीर्णन प्रयोग में α-कण नाभिक के केन्द्र की तरफ गतिशील होता है तथा उससे जितनी दूरी से वापस होता है, वही दूरी उसकी समीपस्थ पहुँच दूरी (क्लोजेस्ट एप्रोच दूरी) कहलाती है। इसे ro से दिखाया जाता है। यहाँ इसकी – O+ नाभिक गतिज ऊर्जा, स्थिर विद्युत स्थितिज ऊर्जा के समान होते हैं।
वापस होता है, वही दूरी उसकी समीपस्थ पहुँच दूरी (क्लोजेस्ट एप्रोच दूरी) कहलाती है। इसे ro से दिखाया जाता है। यहाँ इसकी – O+ नाभिक गतिज ऊर्जा, स्थिर विद्युत स्थितिज ऊर्जा के समान होते हैं।
अत: EP = ![]()
जहाँ EP = स्थिर विधुत स्थितीज उर्जा।
EK = ![]() mV2, जहाँ EK = गतिज उर्जा
mV2, जहाँ EK = गतिज उर्जा
Q.9. कैथोड किरणें क्या है ? समझाएँ।
Ans ⇒ कैथोड किरणें – कैथोड किरणें बहुत से इलेक्ट्रॉनों के तेजगामी प्रवाह हैं जो सभी तत्त्वों में विद्यमान है।
(i) इनकी खोज सर्वप्रथम गोल्डस्टीन ने तरंग प्रवृत्ति के रूप में की।
(ii) ये ऋण आवेशयुक्त होती है।
(iii) इनके मात्रा तथा आवेश इलेक्ट्रॉन के बराबर है। अर्थात इनका आवेश 1.6 x 10-19 C तथा 9.1 x 10-31 kg है।
जब विसर्ग नली का दाब लगभग 10-2 से 10-3 पारे के मिमी तथा उच्च विभवांतर इनके इलेक्ट्रोडों के बीच आरोपित होता है, तो कुछ अदृष्य किरणें कैथोड से निकलती है तथा नली के दीवार पर प्रदीप्ति उत्पन्न करती है कैथोड किरणें कहलाती है।
Q.10. उत्तेजित ऊर्जा तथा आयनीकरण ऊर्जा से आप क्या समझते हैं ?
अथवा, उत्तेजित तथा आयनीकरण विभव क्या है ?
Ans ⇒ उत्तेजित ऊर्जा – उत्तेजित ऊर्जा, ऊर्जा का वह परिमाण है जो एक इलेक्ट्रॉन को ग्राउंड अवस्था से परमाणु के किसी एक उत्तेजित अवस्था में कूदने में लगता है।
हम जानते हैं कि हाइड्रोजन परमाणु के ग्राउंड अवस्था (n = 1) में इलेक्ट्रॉन की ऊर्जा E1 = -13.6eV है, प्रथम उत्तेजित अवस्था में (n = 2) में इलेक्ट्रॉन की ऊर्जा E2 = -3.4 eV है।
अतः हाइड्रोजन परमाणु के प्रथम उत्तेजित ऊर्जा
E2 – E1 = -3.4 – (-13.6) = 10.2 eV
अतः 10.2eV को प्रथम उत्तेजित विभव कहा जाता है।
आयनीकरण ऊर्जा – आयनीकरण ऊर्जा वैसी आवश्यक ऊर्जा है, जिसके परमाणु से एक इलेक्ट्रॉन को बाहर निकाला जाता है। जब इलेक्ट्रॉन को बढ़ाकर कक्षा n = ∞ में ले जाया जाता है, तो वह परमाणु से पूर्णतः बाहर हो जाता है। इसलिए हाइड्रोजन परमाणु के आयनीकरण ऊर्जा n = 1 कक्षा से n = ∞ कक्षा में छोड़ने में आवश्यक ऊर्जा के बराबर होता है।
अर्थात् आयनीकरण ऊर्जा = E∞ – E1 = 0 – (-13.6) = 13.6 eV
अतः हाइड्रोजन परमाणु का आयनीकरण विभव = 13.6 eV है।
Q.11. प्रकाश का फोटो सेल क्या है ?
Ans ⇒ फोटो सेल एक ऐसी व्यवस्था है जिसमें प्रकाश ऊर्जा को विद्युत ऊर्जा में बदला जा सकता है। यह प्रकाश विद्युत प्रभाव के सिद्धांत पर बनी रहती है। यह मुख्यतः दो प्रकाश का होता है -(i) प्रकाश उत्सर्जक सेल (Photo emissive cell) (ii) प्रकाश वोल्टीय सेल (Photo voltaic cell)।
उपयोग – (i) सिनेमाओं में ध्वनि के पुनः उत्पादन (reproduction) में ।
(ii) टेलीविजन तथा फोटोग्राफी में।
(iii) अंतरिक्ष Solar battery द्वारा विद्युत उत्पन्न में।
(iv) सड़कों पर बत्तियों के अपने-आप जलने या बुझने में तथा Crossing पर signal देने के काम में।
(v) दरवाजों को अपने आप खोलने तथा बंद करने में।
(vi) बैंक, खजानों इत्यादि में चोरों की सूचना देने के काम में।
(vii) मौसम विज्ञान विभाग में दिन के प्रकाश की तीव्रता मापने के काम में।
(viii) तारों के ताप मापने के काम में।
