
4. रासायनिक बलगतिकी LONG ANSWER TYPE QUESTIONS
प्रश्न 1. अभिक्रिया की कोटि तथा अणुकता में अन्तर लिखें।
उत्तर⇒ अभिक्रिया की कोटि तथा अणुकता में निम्नलिखित अन्तर हैं-
| अभिक्रिया की कोटि | अणुकता |
| 1. अभिक्रिया में लेने वाले उन अणुओं की संख्या जिनका सान्द्रण परिवर्तन होता है। यह प्रयोग द्वारा ज्ञात की जाती है। इसका मान शून्य, पूर्ण तथा भिन्न भी हो सकते हैं। यह ताप, दाब एवं सान्द्रण पर निर्भर करता है। | अभिक्रिया में भाग लेने वाले कुल अणुओं की संख्या है। यह केवल सैद्धान्तिक मान है। इसका मान हमेशा पूर्ण होता है। यह ताप, दाब तथा सान्द्रण पर निर्भर नहीं करता है। |
प्रश्न 2. प्रथम कोटि प्रतिक्रिया के लिए दर स्थिरांक का व्यंजक प्राप्त करें।
उत्तर⇒ प्रथम श्रेणी अभिक्रियाओं का वेग गुणांक (Rate constant of a first order reaction)-एक सामान्य प्रथम श्रेणी अभिक्रिया के लिए,
A → प्रतिफल
माना कि A का प्रारम्भिक सान्द्रण R0 हैं। जिसमें t समय में x मोल क्रिया कर गये हैं, अतः R मोल शेष बचे हैं।
द्रव्यानुपाती क्रिया के नियमानुसार, अभिक्रिया की दर,- ![]() ∝R
∝R

जहाँ k1 प्रथमक्रम की प्रतिक्रिया का दर स्थिरांक है। उपरोक्त समीकरण (i) का समाकलन (integration) करने पर
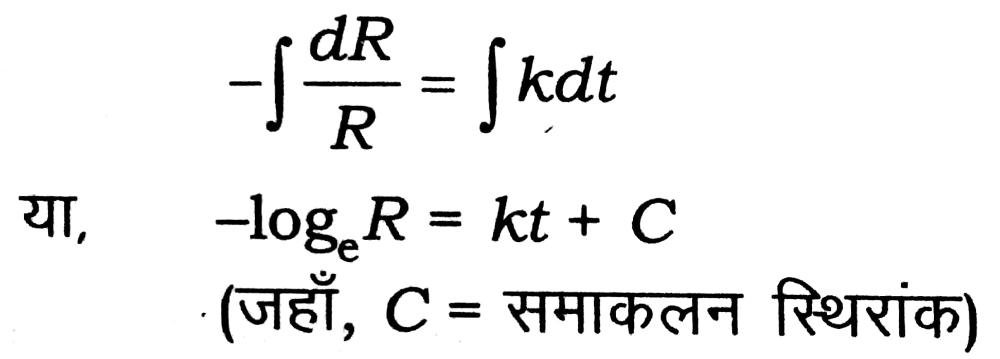
(जहाँ, C = समाकलन स्थिरांक)
प्रारंभ में जब t = 0, R = R0 तब समीकरण (ii) से,
-loge R0 = C
समीकरण (ii) में C का मान रखने पर,
-loge R = kt – logeR
या, kt = loge![]()
![]()
यह प्रथम क्रम अभिक्रिया की दर स्थिरांक का समीकरण कहलाती है।
प्रश्न 3. अर्द्धजीवन काल तथा औसत जीवन काल का वर्णन करें।
उत्तर⇒ अर्द्धजीवन काल-किसी भी रासायानिक प्रतिक्रिया के ठीक अर्द्ध पूरा होने में जो समय लगता है उसे अर्द्धजीवन काल कहा जाता है। इसे t![]() द्वारा सूचित किया जाता है।
द्वारा सूचित किया जाता है।
प्रथम श्रेणी अभिक्रिया- प्रथम श्रेणी अभिक्रिया के लिय,
![]()
जब प्रतिकारक के प्रारम्भिक मात्रा की आधी मात्रा अपघटित हो चुकी है तब R=![]() t = t½
t = t½
प्रथम श्रेणी अभिक्रिया समीकरण में रखने पर,


![]()
समीकरण में क्योंकि अभिकरक की सांद्रता भाग नहीं लेती है। अतः यह स्पष्ट है कि प्रथम श्रेणी की अभिक्रिया में t½ अभिक्रिया के प्रारम्भिक सान्द्रता से मुक्त होती है।
औसत जीवन काल- दर स्थिरांक के व्युत्क्रम को औसत जीवन काल कहा जाता है। इसे T द्वारा सूचित किया जाता है। अर्थात् T = ![]()

औसत आयुकाल = 1.41 × अर्द्धजीवन काल
प्रश्न 4. सक्रियण ऊर्जा को समझावें।
उत्तर⇒ सक्रियण ऊर्जा (Energy of activation)-सभी अणु जो टकराते हैं क्रिया नहीं करते अपितु इसमें कुछ ही अणु अर्थात् सक्रिय अणु ही क्रिया करते हैं अतः जो अणु टकराकर क्रिया फलों में बदलते हैं, वे टकराने से पहले निश्चित मान की ऊर्जा प्राप्त कर सक्रिय अणु बन जाते हैं। यह ऊर्जा जो अणु को सक्रिय बनाने में प्रयोग होते हैं सक्रियण ऊर्जा कहलाते हैं। यह अभिक्रिया पर निर्भर होती है। आरहेनियम के समीकरण से,
k = Ae-Eo/RT
(A = आवृत्तिकारक स्थिरांक, Ea = सक्रियण ऊर्जा T = परमताप)
Ea व A दोनों ही अभिक्रिया पर निर्भर करते हैं।
या, loge K = loge A – ![]()
RT यदि दो तापक्रम, T1 व T2 पर दर स्थिरांक k1 व k2 हो तो,
![]()
प्रश्न 5. समाकलित वेग समीकरण से क्या समझते हैं ? किसी शून्य कोटि एवं प्रथम कोटि की अभिक्रिया के लिए समालित वेग समीकरणों की व्युत्पत्ति करें।
उत्तर⇒ अभिक्रियाओं के सांद्रता पर आधारित तात्कालिक अवकल वेग (समीकरण) निर्धारण आसान नहीं होता है। इससे वेग नियम एवं अभिक्रिया की कोटि को ज्ञात करना कठिन हो जाता है। इस जटिलता से बचने के लिए समीकरण को समाकलित करके समाकलित वेग समीकरण ज्ञात कर लिया जाता है। इससे विभिन्न समय पर अभिक्रियाओं की सांद्रता तथा वेग स्थिरांक के बीच संबंध ज्ञात हो जाता है।
शून्य कोटि की अभिक्रिया के लिए समाकलित वेग समीकरण की व्युत्पत्ति-कोई अभिक्रिया R → P एक शून्य कोटि की अभिक्रिया है।

या, -d [R] = K.dt
दोनों तरफ समाकलन करने पर- [R] = – Kt + I …(A)
जहाँ I = समाकलन स्थिरांक
जब, t = 0 हो, तो R की सांद्रता = [R]0 होगी।
[जहाँ [R]0 अभिक्रिया की प्रारंभिक सांद्रता]
अब, समीकरण (A) में [R]0 का मान रखने पर
[R]o = – K × 0 + I = I
पुनः I का मान समीकरण (A) में रखने पर
[R] = – Kt + [R]o ….(B)
या, – Kt = [R] – [R]o
या, Kt = [R]o – [R]
और K = ![]() ….(C)
….(C)
प्रथम कोटि की अभिक्रिया के लिए समाकलित वेग समीकरण की व्युत्पत्ति
किसी अभिक्रिया R → P के लिए

इस समीकरण का समाकलन करने पर- In [R] = – Kt + I …(D)
जहाँ I समाकलन स्थिरांक है।
जब t = 0, [R] = [R]0 जहाँ [R]0 = प्रारंभिक सांद्रता
समीकरण (D) के अनुसार, In [R]0 = –K × O+ I = I

इस प्रकार समीकरण (C) एवं (E) क्रमशः शून्य कोटि एवं प्रथम कोटि की अभिक्रियाओं के लिए स्थिरांक (K) प्राथमिक सांद्रता एवं अंतिम सांद्रता के बीच संबंध बताता है। इन्हें ही समाकलित वेग समीकरण कहा जाता है।
प्रश्न 6. अभिक्रिया की अणुकता एवं कोटि को समझाएँ।
उत्तर⇒ अणुकता (Molecularity)-किसी अभिक्रिया में भाग लेने वाले परमाणुओं या अणुओं की न्यूनतम संख्या को अभिक्रिया की अणुकता कही जाती है।
उदाहरण-
(i) हाइड्रोजन परऑक्साइड के अपघटन में इसका कम-से-कम एक अणु भाग लेता है।
H2O2 → H2O + ½O2
अतः इस अभिक्रिया की अणुकता = 1 है।
(ii) सोडियम हाइड्रॉक्साइड द्वारा इथाइल ऐसीटेट के जल अपघटन में दोनों के एक-एक अणु भाग लेते हैं।
CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
अतः इस अभिक्रिया की अणुकता = 1 + 1 = 2
जिस अभिक्रिया की अणुकता 1 होती है। उसे एक अणुक अभिक्रिया कहा जाता है। इसी प्रकार 2 तथा 3 अणुकता वाली अभिक्रियाएँ क्रमशः द्विअणुक और त्रिअणुक अभिक्रिया कहलाती है।
अभिक्रिया की कोटि (Order of reaction)-वेग समीकरण में प्रयुक्त सान्द्रण पदों के घातों के योगफल को अभिक्रिया की कोटि कहा जाता है।
मान लिया कि किसी अभिक्रिया का वेग निम्नलिखित प्रकार से व्यक्त किया जाता है।
वेग K[A]n1[B]n2[C]n3
जहाँ n1, n3 क्रमशः अभिकारक A, B तथा C के सान्द्रण के घात हैं तथा K एक स्थिरांक है।
∴ अभिक्रिया की कोटि = n1 + n2 + n3
उदाहरण
(i) X → प्रतिफल, वेग = K (X)1
∴ अभिक्रिया की कोटि = 1
(ii) x + Y → प्रतिफल, वेग = K [X]’ [Y]1
∴ अभिक्रिया की कोटि = 1 + 1 = 2
(iii) CH3COOCH3 + H2O![]() CH3COOH+CH3OH
CH3COOH+CH3OH
वेग = K.[CH3COOCH3]4 × स्थिरांक
∴ अभिक्रिया की कोटि = 1
प्रश्न 7. वेग स्थिरांक पर ताप के प्रभाव को समझाएँ।
उत्तर⇒ वेग स्थिरांक पर ताप का प्रभाव-अभिक्रिया का वेग ताप वृद्धि के साथ बढ़ जाता है। यह देखा गया है कि सामान्यतः 10°C ताप वद्धि से अभिक्रियाओं का वेग स्थिरांक लगभग दुगुना या तिगुना हो जाता है।
ताप के प्रभाव को ताप गुणांक के रूप में व्यक्त किया जाता हैं ताप गुणांक उन दो तापों पर वेग स्थिरांकों का अनुपात है जिसमें 10°C का अन्तर हो।
![]()
उदाहरण-KClO3 का वियोजन 2KCIO3 → 2 KCl + 3O2 तापक्रम की वृद्धि या 10°C तापक्रम बढ़ाने पर KClO3 का वियोजन का दर लगभग दुगुना हो जाता है। ताप में वृद्धि होने पर अणुओं की गति बढ़ जाती है अतः टक्करों की संख्या बढ़ जाती है। जब टक्करों की संख्या बढ़ती है तो प्रतिक्रिया की दर भी बढ़ जाती है। आरहेनियस ने अपने प्रायोगिक निरीक्षणों के आधार पर प्रतिक्रिया के वेग पर ताप के प्रभाव को निम्न समीकरण द्वारा व्यक्त किया-
![]()
जहाँ K = प्रतिक्रिया का वेग स्थिरांक, T = तापक्र (केल्विन में) R = गैस स्थिरांक तथा, Ea = प्रतिक्रिया की सक्रियण ऊर्जा
यदि Ea ताप के सापेक्ष स्थिर हो तो इस समीकरण का अवकलन करने पर In K = ![]() + C (जहाँ C = अवकलन स्थिरांक है)
+ C (जहाँ C = अवकलन स्थिरांक है)
इन स्थिरांक का मान In A के बराबर होता है।
अतः In K = – ![]() + InA
+ InA
या In K / A = –![]()
या K = ![]()
जहाँ A को कम्पनावृत्ति गुणक कहा जाता है। उपर्युक्त समीकरण
In K = –![]() + In A
+ In A
या, In K = In A–![]()
या, 2.303log K = 2.303 log A – ![]()
या, log K = log A- ![]()
मान लिया कि T1 ताप पर वेग स्थिरांक K1 तथा T2 ताप पर स्थिरांक K2 है, तो
log K1 = log A- ![]()
तथा log K2 = log A- ![]()
दोनों को घटाने पर हम पाते हैं कि
![]()
उपर्युक्त समीकरण से हम वेग स्थिरांक का मान निकाल सकते हैं।
प्रश्न 8. शून्य क्रम की प्रतिक्रिया से आप क्या समझते हैं ?
उत्तर⇒ (a) शून्य क्रम प्रतिक्रिया वह रासायनिक प्रतिक्रिया है जिसके प्रतिक्रिया की दर किसी प्रतिकारक के सांद्रण पर निर्भर नहीं करता है, शून्य क्रम की प्रतिक्रिया कहलाता है। ऐसी स्थिति में प्रतिक्रिया स्थिर दर से आगे बढ़ती है।
शून्य कोटि की प्रतिक्रिया के लिए,
दर = K = स्थिरांक
(i) NH3 का प्लैटिनम सतह पर विघटन (ii) HI का सोने के सतह पर विघटन
(b) रासायनिक प्रतिक्रिया की दर को प्रभावित करने वाले निम्नलिखित कारक हैं-
(i) प्रतिकारकों का सांद्रण-प्रतिकारकों के सांद्रण बढ़ने से प्रतिक्रिया की दर बढ़ता है।
(ii) उत्प्रेरक की उपस्थिति-उत्प्रेरक Activation energy को घटाकर प्रतिक्रिया दर बढ़ाता है।
तापक्रम-प्रतिक्रिया की दर तापक्रम बढ़ने से बढ़ता है। तापक्रम बढ़ने से प्रभावी टक्करों की संख्या बढ़ जाती है जो प्रतिक्रिया की दर को बढ़ा देता है। यह पाया गया है कि प्रत्येक 10°C तापक्रम बढ़ने से प्रायः प्रतिक्रिया की गति दुगुनी हो जाती है।
(iii) सतह का क्षेत्रफल-प्रतिक्रिया की गति प्रतिकारकों के सतह के क्षेत्रफल बढ़ने से बढ़ता है।
(iv) एक्टीवेशन ऊर्जा-एक्टीवेशन ऊर्जा के मान कमने से प्रतिक्रिया की दर बढ़ती है।




