
1. ठोस अवस्था LONG ANSWER TYPE QUESTIONS
भौतिक रसायन
1. ठोस अवस्था
प्रश्न 1. अक्रिस्टलीय ठोसों (Amorphous solids) तथा क्रिस्टलीय ठोसों (Crystalline solids) में अंतर स्पष्ट करें।
उत्तर⇒ अक्रिस्टलीय ठोस तथा क्रिस्टलीय ठोस में निम्न अंतर है-
| अक्रिस्टलीय ठोस | क्रिस्टलीय ठोस |
| 1. इनकी आकृति निश्चित नहीं होती है क्योंकि इनके घटक कण नियमित क्रम में व्यवस्थित नहीं रहते हैं। | 1. इनकी आकृति निश्चित होती है, क्योंकि इनके घटक कण नियमित क्रम में व्यवस्थित रहते हैं। |
| 2. इनकी आकृति अनियमित होती है। | 2. इनकी निश्चित ज्यामितीय आकृति होती है। |
| 3. इनके गलनांक निश्चित नहीं होते हैं। | 3. इनके गलनांक निश्चित होते हैं। |
| 4. ये समदैक्षिक होते हैं। | 4. ये विषमदैक्षिक होते हैं। |
| 5. इनकी संलयन ऊष्मा निश्चित नहीं होती है। | 5. इनकी संलयन ऊष्मा निश्चित होती है। |
| 6. ये छदम ठोस या अतिशितित द्रव होते हैं। | 6. ये वास्तविक ठोस होते हैं। |
प्रश्न 2. शॉटकी तथा फ्रेंकेल त्रुटियों में अंतर स्पष्ट करें।
उत्तर⇒ शॉटकी तथा फ्रेंकेल त्रुटियों में निम्नलिखित अंतर है-
| शॉटकी त्रुटि | फ्रेंकेल त्रुटि |
| 1. इस दोष में धनायन तथा ऋणायन संख्या में बराबर होते हैं। | 1. संख्या में बराबर नहीं होते हैं। |
| 2. इस दोष में धनायन तथा ऋणायन अपने जालक स्थलों से पूर्णतः विस्थापित हो जाते हैं। | 2. इस दोष में कोई भी आयन धनायन या ऋणायन अपने जालक बिन्दु को छोड़कर अन्तराकाशी स्थल में आ जाते हैं। |
| 3. इस दोष में क्रिस्टल का घनत्व घट जाता हैं। | 3. इस दोष में घनत्व में परिवर्तन नहीं होता हैं। |
| 4. यह दोष अधिक उप सह-संयोजन संख्या वाले आयनों (ठोसों) में पाया जाता है। | 4. संख्या वाले आयनिक ठोसों में पाया जाता है। |
| 5. इस दोष में क्रिस्टल में धनायन एवं ऋणायन लगभग समान आकार के | 5. ऋणायन से कम होता है। |
प्रश्न 3. (i) उपसहसंयोजन संख्या का क्या अर्थ है ?
(ii) निम्नलिखित परमाणुओं की उपसहसंयोजन संख्या क्या होती है ?
(क) एक घनीय निविड संकुलित संरचना
(ख) एक अंत: केंद्रित घनीय संरचना।
उत्तर⇒ (i) उपसहसंयोजक संख्या किसी क्रिस्टल में उपस्थित परमाणु के चारों ओर उन परमाणुओं की संख्या जो केंद्रित परमाणु को छूते हों। यह संख्या उस परमाणु की उपसहसंयोजक संख्या कहलाती है। आयनिक क्रिस्टल के केंद्रीय आयन के चारों ओर विपरीत आवेश के आयनों की संख्या केंद्रीय आयन की उपसहसंयोजन संख्या कहलाती है।
(ii) (क) ccp में उपस्थित परमाणु के चारों ओर 12 परमाणु उपस्थित होते हैं जो उनकी उपसहसंयोजन संख्या कहलाती है।
(ख) bcc में केंद्रीय परमाणु के चारों ओर उपस्थित परमाणुओं की संख्या आठ होती है जो इस संरचना में परमाणु की उपसहसंयोजन संख्या कहलाती है।
प्रश्न 4. निम्नलिखित जालकों में से प्रत्येक की एकक कोष्ठिका में कितने जालक बिन्दु होते हैं ?
(i) फलक-केंद्रित घनीय,
(ii) फलक-केंद्रित चतुष्कोणीय,
(iii) अंतःकेंद्रित
उत्तर⇒ (i) और (ii)
फलक केंद्रित घनीय या चतुष्कोणीय में जालक बिन्दु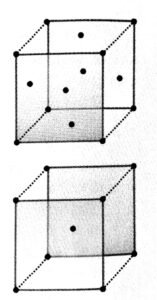
= 8 कोनों पर + 6 फलक पर = 14
प्रति एकक कोष्ठिका में अवयव
= 8×![]() +6×
+6×![]() = 1+3 = 4
= 1+3 = 4
fcc – 8 जालक बिन्दु कोणों पर 6
जालक बिन्दु फलक जालक पर
(iii) अंतः केंद्रित (BCC) में जालक
बिन्दु 8 कोणों पर + 1 केंद्रित बिंदु पर
हालाँकि प्रति एकक कोष्ठिका में
अवयव = 8×![]() +1=2
+1=2
प्रश्न 5. निम्नलिखित को उचित उदाहरणों से समझाइए-
(i) लौह चुंबकत्व
(ii) अनुचुंबकत्व
(iii) फेरीचुंबकत्व
(iv) प्रतिलौह चुंबकत्व
(v) 12-16 और 13-15 वर्गों के यौगिक।
उत्तर⇒ (i) लौह चुंबकीय-कुछ पदार्थ जैसे लोहा, कोबाल्ट, निकेल और CrO2 बहुत प्रबलता से चुंबकीय क्षेत्र की ओर आकर्षित होते हैं। ऐसे पदार्थों को लौहचुंबकीय पदार्थ कहा जाता है। प्रबल आकर्षणों के अतिरिक्त ये स्थायी रूप से चुंबकित किए जा सकते हैं। पदार्थ को चुंबकीय क्षेत्र में रखने पर सभी डोमेन चुबकीय क्षेत्र की दिशा में अभिविन्यसित हो जाते हैं और प्रबल चुंबकीय प्रभाव उत्पन्न होता है। चुंबकीय क्षेत्र को हटा लेने पर भी डोमेनों का क्रम बना रहता है और लौहचुंबकीय पदार्थ स्थायी चुंबक बन जाते हैं।
↑↑↑↑↑↑↑↑ लौह चुंबकीय पदार्थ
(ii) अनुचुंबकत्व-अनुचुंबकीय पदार्थ चुंबकीय क्षेत्र की ओर दुर्बल रूप से आकर्षित होते हैं। ये चुंबकीय क्षेत्र की दिशा में ही चुंबकित हो जाते हैं | ये चुंबकीय क्षेत्र की अनुपस्थिति में अपना चुंबकत्व खो देते हैं। अनुचुंबकत्व का कारण एक अथवा अधिक अयुगलित इलेक्ट्रॉनों की अनुपस्थिति है, जो कि चुंबकीय क्षेत्र की ओर आकर्षित होते हैं। O2, Cu+2, Fe+3, Cr+3 ऐसे पदार्थों के कुछ उदाहरण हैं।
(iii) फेरीचुंबकत्व-जब पदार्थ में डोमेनों के चुंबकीय आघूर्णों का संरेखण समानांतर एवं प्रतिसमानांतर दिशाओं में आसान होता है तब पदार्थ में फेरीचुंबकत्व देखा जाता है। ये मैग्नेटाइट और फेराइट जैसे Mg, Fe2O4,
ZnFe2O4 ऐसे पदार्थों के उदाहरण होते हैं। Fe3O4 गरम करने पर फेरीचुंबकत्व खो देते हैं और अनुचुंबकीय बन जाते हैं।
↑↑↓↑↑↓
(iv) प्रतिलौह चुबकत्व-प्रतिलौहचुंबकत्व प्रदर्शित करनेवाले पदार्थ जैसे MnO में डोमेन संरचना लौहचुंबकीय पदार्थ के सदृश होती है, परंतु उनके डोमेन एक-दूसरे के विपरीत अभिविन्यासित होते हैं तथा एक-दूसरे के चुंबकीय आघूर्ण को निरस्त कर देते हैं।
↑↓↑↓↑↓
(v) 12 – 16 और 13 – 15 वर्गों के यौगिक- दो अवयव रखनेवाले ठोस यौगिक बनाते हैं। वर्ग 13 और 15 तथा 12 और 16 वर्गों से बने यौगिकों को दो वर्गों में बाँटा जा सकता है-
(a) 12 – 16 यौगिक- ZnS, CdS, CdSe, HgTe आयन प्रकृति के होते हैं।
(b) 13 – 15 यौगिक- A/P, GaAs, InSn आदि यौगिक सहसंयोजक यौगिक बनते हैं। ये यौगिक विद्युत और प्रकाशित गुणों को दर्शाते हैं। वे अर्धचालक होते हैं।
प्रश्न 6. (क) एकक कोष्ठिका और क्रिस्टल जालक को परिभाषित करें। इनके गुणों का वर्णन करें।
(ख) ठोस के गुणधर्मों का वर्णन करें। क्रिस्टलीय और अक्रिस्टलीय ठोस क्या है ?
उत्तर⇒ (क) क्रिस्टल जालक-क्रिस्टल में अवयवी कणों की त्रिविमीय व्यवस्था को आरेख के रूप में निरूपित करके जिसमें प्रत्येक कण को बिंदु द्वारा चित्रित किया जाता है तो यह व्यवस्था क्रिस्टल जालक कहलाती है। यह दिक्स्थान जिसमें बिन्दुओं की नियमित त्रिविमीय व्यवस्था हो क्रिस्टल जालक कहलाती है।
क्रिस्टल जालक के अभिलक्षण- (i) जालक में प्रत्येक बिन्दु जालक बिंदु अथवा जालक स्थान कहलाता है।
(ii) क्रिस्टल जालक का प्रत्येक बिंदु एक अवयवी कण को निरूपित करता है जो एक परमाणु, एक अणु अथवा एक आयन हो सकता है।
(iii) जालक बिंदुओं को सीधी रेखाओं से जोड़ा जाता है जिससे जालक की ज्यामिति व्यक्त की जा सके ।
एकक कोष्ठिता- एकक कोष्ठिता क्रिस्टल जालक का लघुतम भाग है, इसे जब विभिन्न दिशाओं में पुनरावृत्त किया जाता है तो पूर्ण जालक की उत्पत्ति होती है।
 एकक कोष्ठिका की अभिलाक्षणिक गुण- (i) उसके तीनों किनारों की विमाओं a, b और c के द्वारा जो कि परस्पर लंबवत् हो भी सकते हैं अथवा नहीं भी।
एकक कोष्ठिका की अभिलाक्षणिक गुण- (i) उसके तीनों किनारों की विमाओं a, b और c के द्वारा जो कि परस्पर लंबवत् हो भी सकते हैं अथवा नहीं भी।
(ii) किनारों के मध्य कोण α, β और γ के द्वारा इस प्रकार एकक कोष्ठिका छ: पैरामीटरों a, b, c, α, β, γ द्वारा अभिलक्षणित होती है।
(ख) ठोस अवस्था के निम्न गुण-धर्म हैं
(i) ठोस पदार्थों का आयन, द्रव्यमान और आकृति निश्चित होती है।
(ii) अन्तर अणु (अवयव) दूरी कम होती है।
(iii) अन्तर अणु (अवयव) बल प्रबल होता है।
(iv) ठोस के अवयव (परमाणु अणु या आयन) निश्चित स्थान पर होते हैं।
(v) ठोस कठोर होते हैं।
क्रिस्टलीय और अक्रिस्टलीय ठोस- सभी ठोस पदार्थ दो वर्गों में विभक्त किए जा सकते हैं-
(i) क्रिस्टलीय ठोस- इस प्रकार के ठोस के अवयव छोटे होते हैं और ये निश्चित अभिलाक्षणिक ज्यामितीय आकार के होते हैं। इनकी प्रकृति वास्तविक ठोस दीर्घ परासी व्यवस्था होती है। जैसे NaCl और क्वार्ट्स।
(ii) अक्रिस्टलीय ठोस-अक्रिस्टलीय ठोस असमाकृति आकार की आकृति होती है। इनका गलनांक ताप के एक परास में धीरे-धीरे नरम पड़ते हैं। इनकी गलन ऊष्मा निश्चित नहीं होती है। इनका गलनांक ताप के एक परास में धीरे-धीरे नरम पड़ते हैं। इनकी गलन ऊष्मा निश्चित नहीं होती। समदैशिक प्रकृति के होते हैं। इस प्रकार के ठोस आभासी ठोस अथवा अतिशीतित द्रव गुण दर्शाते ही अवयव केवल लघु परासी व्यवस्था में होते हैं। उदाहरण क्वार्ट्स काँच।




