
Class 12th Chemistry ( p-ब्लॉक तत्त्व ) Short Answer Type Question in Hindi Pdf Download Inter Exam 2022
अकार्बनिक रसायन
प्रश्न 1. उत्कृष्ट गैसें (Noble Gases) निष्क्रिय क्यों होती है ? स्पष्ट करें।
उत्तर⇒ निम्नलिखित कारणों से उत्कृष्ट गैसें निष्क्रिय होती है
(i) उत्कृष्ट गैसों के आयनीकरण एन्थैल्पी का मान अधिक होता है।
(ii) इनकी इलेक्ट्रॉन की बन्धता लगभग शून्य होती है।
प्रश्न 2. व्याख्या करें कि नाइट्रोजन अणु कम क्रियाशील होते हैं।
उत्तर⇒ जैसा कि हम जानते हैं कि नाइट्रोजन अणुओं के बीच त्रिबंध (N ≡ N) होता है, इसलिए नाइट्रोजन कम क्रियाशील होते हैं।
प्रश्न 3. SiF![]() आयन संभव है लेकिन SiCl
आयन संभव है लेकिन SiCl![]() नहीं क्यों ?
नहीं क्यों ?
उत्तर⇒ (i) छोटे आकार के कारण SiF![]() में प्रतिकर्षण कम है।
में प्रतिकर्षण कम है।
(ii) Si-F आबंध छोटा होने के कारण आबंधित इलेक्ट्रॉन युग्म व आबंध इलेक्ट्रॉन युग्म व आबंध इलेक्ट्रॉन में प्रतिकर्षण अधिकत।
प्रश्न 4. श्वेत फॉस्फोरस को जल में क्यों रखा जाता है ? तीन लवणों का नाम लिखें जो ऑर्थोफॉस्फोरस अम्ल तथा NaOH की क्रिया से बनते हैं।
उत्तर⇒ (i) श्वेत फॉस्फोरस का ज्वलन ताप बहुत कम है (303 K) वायु में जल उठता है अतः इसे जल में रखा जाता है।
(ii) NaH2 PO4. Na2HPO4 और Na3PO4.
प्रश्न 5. नाइट्रिक अम्ल के ऑक्सीकारक गुण को प्रदर्शित करने के लिए एक रासायनिक समीकरण दीजिए।
उत्तर⇒ H2S + 2HNO3 → 2H2O + 2NO2 + S
प्रश्न 6. अमोनिया गैस को शुष्क करने के लिए P4O10 प्रयुक्त नहीं की जा सकती है ?
उत्तर⇒ P4O10 अम्लीय है तथा NH3 भस्मीय है। नमी की उपस्थिति में यह अमोनिया के साथ अभिक्रिया करके अमोनियम फॉस्फेट बनाती है।
P4O10 + 12NH4OH → 4(NH4)3 PO4 + 6H2O
प्रश्न 7. नाइट्रोजन NF3 बनाती है लेकिन NF5 नहीं। समझाइये।
उत्तर⇒ नाइट्रोजन के संयोजी कोश में रिक्त d – कक्षक नहीं होता है। इसलिए यह अपनी सहसंयोजकता तीन से ज्यादा नहीं बढ़ा सकता। जिसके परिणामस्वरूप NF3 बन सकता है लेकिन NF5 नहीं।
प्रश्न 8. नाइट्रोजन पेन्टाहेलाइड नहीं बनता हैं समझाइये।
उत्तर⇒ नाइट्रोजन के अंतिम कक्ष में रिक्त उपकक्ष नहीं है। अतः यह अपनी सह संयोजकता को तीन से बढ़ाकर पाँच नहीं कर सकता है।
प्रश्न 9. H3PO2 एक क्षारीय अम्ल की तरह क्यों कार्य करता है ?
उत्तर⇒ H3PO2 (हाइपोफास्फोरिक अम्ल) एक क्षारीय अम्ल की तरह कार्य करता है क्योंकि इसके पास OH समूह के रूप में केवल एक प्रतिस्थापन योग्य हाइड्रोजन परमाणु होता है।
प्रश्न 10. फास्फोरस नाइट्रोजन की अपेक्षा अधिक केटीनेशन दर्शाता है। समझाइए।
उत्तर⇒ P-P एकल बंध N – N एकल बंध की अपेक्षा प्रबल होती है। इसलिए फास्फोरस में नाइट्रोजन की अपेक्षा अधिक केटीनेशन गुण होता है।
प्रश्न 11. PH3 अणु में आबंध कोण NH3 से कम क्यों हैं ?
उत्तर⇒ PH3 में आबंध कोण (93.6°) है जबकि NH3 में आबंध कोण (107.8°) है क्योंकि नाइट्रोजन (3), फॉस्फोरस (2.1) की अपेक्षा आकार में छोटा और अधिक विद्युत्ऋणी है। फलस्वरूप, आबंधों में प्रतिकर्षण अधिक होता है।
प्रश्न 12. परऑक्साइड आयनों में ऑक्सीजन की क्या ऑक्सीकरण अवस्था होती है ?
उत्तर⇒ परऑक्साइड (O![]() ) आयनों में ऑक्सीजन अवस्था- 1 होती है।
) आयनों में ऑक्सीजन अवस्था- 1 होती है।
प्रश्न 13. सल्फर का पीला अवक्षेप क्यों विलुप्त हो जाता है जब इसे सोडियम सल्फाइट के साथ उबालते हैं ?
उत्तर⇒ सल्फर का पीला अवक्षेप सोडियम सल्फाइट के साथ उबालने पर विलुप्त हो जाता है क्योंकि घुलनशील सोडियम थायोसल्फेट का निर्माण हो जाता है।
Na2SO3+S![]() Na2S2O3
Na2S2O3
(पीला अवक्षेप) सोडियम थायोसल्फेट
. (घुलनशील)
प्रश्न 14. सल्फर वाष्प अवस्था में अनुचुम्बकीय व्यवहार क्यों प्रदर्शित करता है ?
उत्तर⇒ बाष्प अवस्था में सल्फर विघटित होकर द्विपरमाणुविक S2 बनाता है। इनके आण्विक कक्षक (MO) विन्यास ऑक्सीजन (O2) के समान हैं। एन्टीबान्डिग π – कक्षकों में अयुग्मित इलेक्ट्रॉनों की उपस्थिति के कारण यह अनुचुम्बकीय लक्षण प्रदर्शित करता है।
प्रश्न 15. जलीय जंतु ठंढे जल में ज्यादा स्वस्थ रहते हैं गर्म जल की तुलना में, कैसे ?
उत्तर⇒ ताप बढ़ने पर ऑक्सीजन गैस की विलेयता जल में घटने लगती है। इसीलिए जलीय जंतु ठंडे जल में ज्यादा स्वस्थ रहते है गर्म जल की तुलना में।
प्रश्न 16. H3PO4 में O – H बंध होने के कारण यह डाइबेसिक है। HNO3 एवं H2S की प्रतिक्रिया बतायें।
उत्तर⇒

प्रश्न 17. HBr एवं HI की प्रतिक्रिया सान्द्र HNO3 के साथ बतायें।
उत्तर⇒ 2HNO3 + 2HI → 2NO2 + I2 + 2H2O
प्रश्न 18. क्या होता है जब NaBr, सान्द्र गंधकाम्ल एवं MnO2 को गर्म करते हैं ? प्रतिक्रिया लिखें।
उत्तर⇒
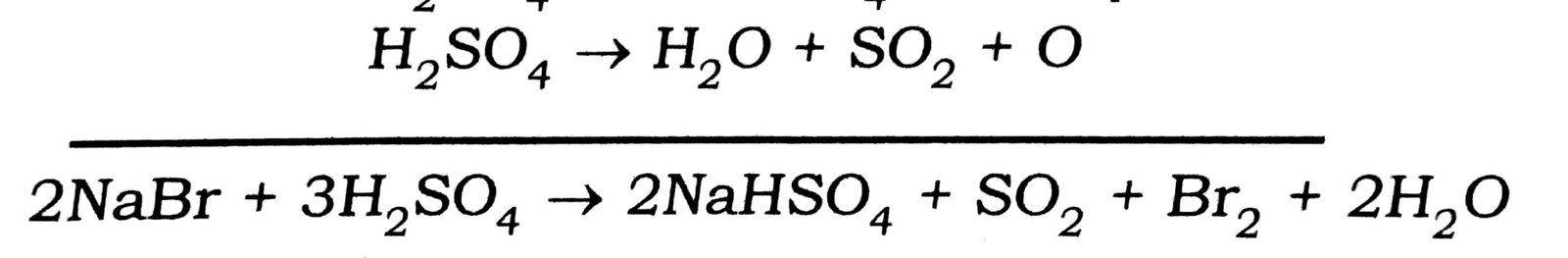
प्रश्न 19. शुष्क SO2 सूखे पुष्प को ब्लीच नहीं करता परन्तु नमी वाले SO2 पुष्प के रंग को रंगहीन कर देता है। वर्णन करें।
उत्तर⇒ SO2 जल से प्रतिक्रिया कर नवजात हाइड्रोजन देता है। SO2 + 2H2O → H2SO4 + 2[H]
रंगीन पदार्थ + [H] – रंगहीन
अतः सूखा SO2 फूल का ब्लीच नहीं करता जबकि नमी वाले SO2 फूल को ब्लीच करता है।
प्रश्न 20. वर्णन करें-
(a) स्वीमिंग पुल में ओजोन क्यों इस्तेमाल किया जाता है ?
(b) ओजोन Hg को क्यों नष्ट कर देता है ?
उत्तर⇒ (a) सूक्ष्म मात्रा में ओजोन का प्रयोग जीवाणुदायी के रूप में किया जाता है अतः स्वीमिंग पुल में ओजोन का इस्तेमाल जीवाणुदायी गंध को खत्म करने के रूप में किया जाता है।
(b) ओजोन की उपस्थिति के कारण मरकरी सबऑक्साइड में ऑक्सीकत हो जाता है और ग्लास से चिपकने लगता है साथ ही अपनी चालकता खो देता है।
2H2 + O3 → H2O + O2
प्रश्न 21. नाइट्रोजन NCl5 नहीं बनाता है जबकि फॉस्फोरस PCl5 बनाता है व्याख्या करें।
उत्तर⇒ नाइट्रोजन तथा फास्फोरस की सामान्य स्थिति में इलेक्ट्रॉन संरचना
7N = 1s22s22px12py12pz1
15P = 1s22s22p6 3s23px 12py12pz13d0
p में इलेक्ट्रॉन उत्तेजित अवस्था में 3s से 3d में जाता है लेकिन नाइट्रोजन में नहीं क्योंकि इसमें संयोजी कक्षा में खाली orbitals नहीं है। इसलिए P, PCl5 बनाता है। लेकिन N, NCl3 नहीं बनाता है।
प्रश्न 22. व्याख्या कीजिये-
(a) सल्फर वाष्प पाराचुम्बकीय है।
(b) H3PO3 द्विपोटॉनिक (diprotic) अम्ल है।
उत्तर⇒ (i) सल्फर वाष्पित अवस्था में द्विपरमाण्विक S2, रूप में रहता है, जिसमें दो अयुग्मित इलेक्ट्रान प्रतिकुल बंधन आण्विक आरविटल (ABMO) में रहता है। इसलिये यह चुम्बकीय क्षेत्र में आकर्षित होता है और पाराचुम्बकत्व प्रदर्शित करता है।
(b) H3PO3 केवल दो ही विस्थापित योग्य हाइड्रोजन रखता है, इसलिये यह डाइप्रोटीक अम्ल है। यह इसके संरचना से रपष्ट होता है।

प्रश्न 23. NH3 हाइड्रोजन बंध बनाती है। परन्तु PH3 नहीं बनाती क्यों ?
उत्तर⇒ अमोनिया में N परमाणु हाइड्रोजन आबंध बनाता है परन्तु PH3 में कोई हाइड्रोजन आबंध बनाने की योग्यता नहीं है। क्योंकि- (i) N का परमाणु आकार P से छोटा है।
(ii) N का वैद्युतट्टणात्मकता मान P से अधिक है।
प्रश्न 24. बतायें कि क्यों NH3 क्षारकीय है जबकि BiH3 केवल दुर्बल क्षारक है ?
उत्तर⇒ NH3 और BiH3 में केन्द्रीय परमाणु पर इलेक्ट्रॉन युग्म उपस्थित होता है जिस कारण में लुईस क्षार की भांति व्यवहार करते हैं| NH3 से BiH3 तक क्षार गुण का होता जाता है क्योंकि परमाणु आकार बढ़ने से इलेक्ट्रॉन घनत्व कम होता जाता है। अतः इलेक्ट्रॉन युग्म त्यागने की प्रवृत्ति कम होती है। इसलिए क्षारक युण घटता है।
प्रश्न 25. क्या होता है जब श्वेत फॉस्फोरस को CO2 को अक्रिय वातावरण में सांद्र कास्टिक सोडा विलयन के साथ गर्म करते हैं ?
उत्तर⇒ जब श्वेत फॉस्फोरस को NaOH के साथ गरम किया जाता है तथा CO2 द्वारा उदासीन वातावरण दिया जाता है तब PH3 का निर्माण होता है।
P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2
प्रश्न 26. नाइट्रोजन के पास भी फॉस्फोरस की तरह पाँच संयोजी इलेक्ट्रॉन होते हैं लेकिन NCl5 नहीं बनाता है जबकि फॉस्फोरस PCl5 बनाता है, समझाइये।
उत्तर⇒ नाइट्रोजन अपनी सहसंयोजकता तीन से पाँच तक नहीं बढ़ा सकता क्योंकि उसमें d – कक्षकों अनुपस्थित होती है। लेकिन फॉस्फोरस खाली 3d -कक्षक होने के कारण अपनी संयोजकता पाँच तक बढ़ा सकता है। इसलिए PCl5 बनता है लेकिन NCl5 नहीं।
प्रश्न 27. नाइट्रोजन का कौन-सा ऑक्साइड रॉकेट में ईंधन की तरह प्रयुक्त किया जाता है ?
उत्तर⇒ डाइनाट्रोजन टेट्राऑक्साइड (N2O4) रॉकेट में ईंधन की तरह प्रयुक्त होता है।
प्रश्न 28. नाइट्रिक ऑक्साइड निकलने के तुरन्त बाद लाल-भूरा क्यों हो जाता है ?
उत्तर⇒ नाइट्रिक ऑक्साइड (NO) एक रंगहीन गैस है, लेकिन यह अत्यधिक अस्थायी होती है। जब यह गैस निकलती है यह वायु में उपस्थित ऑक्सीजन के साथ जुड़कर NO2 (नाइट्रोजन डाइऑक्साइड) बनाती है जो कि लाल भूरी होती है।
2NO(g) + O2 (g) → 2NO2(g)
रंगहीन (लाल भूरी)
प्रश्न 29. NO गैसीय अवस्था में अनुचुम्बकीय होता है लेकिन ठोस व द्रव अवस्था में प्रतिचुम्बकीय होता है। स्पष्ट करें।
उत्तर⇒ NO के पास इलेक्ट्रॉानों की विषम संख्या (7 + 8 = 15) होती है तथा अयुग्मित इलेक्ट्रॉन की उपस्थिति के कारण यह गैसीय अवस्था में
अनुचुम्बकीय होता है। किन्तु द्रव व ठोस अवस्था में इसका आयुग्मित इलेक्ट्रॉन ढीले द्विअणुक बनाने में प्रयुक्त होते हैं। अयुग्मित इलेक्ट्रॉन न होने की वजह से यह प्रतिचुम्बकीय प्रकृति का होता है।
प्रश्न 30. SF6 ज्ञात यौगिक हैं लेकिन SCl6 अज्ञात हैं। समझाइये।
उत्तर⇒ क्लोरीन परमाणु का आकार बहुत बड़ा होता है। इसलिए 6 क्लोरीन परमाणु एक सल्फर परमाणु के साथ नहीं जुड़ सकते जबकि 6 फ्लोरीन परमाणु छोटे आकार के कारण जुड़ सकते हैं। इसके अतिरिक्त क्लोरीन फ्लूलोरीन की अपेक्षा कम विद्युत् ऋणता के कारण सल्फर रिक्त d कक्षकों में इलेक्ट्रॉन का अयुग्मन नहीं कर सकता है जबकि फ्लूलोरीन अपनी उच्च विद्युत् ऋणता के कारण ऐसा कर सकता है।
प्रश्न 31. ऑक्सीजन द्विपरमाण्वीय व गैस अवस्था में मिलता है। वर्णन करें।
उत्तर⇒ छोटे आकार व उच्च वैद्युत ऋणात्मकता के कारण ऑक्सीजन pπ – pπ उच्चबंध दर्शाता है अतः द्विपरमाणु के रूप में रहता है। द्विपरमाणुक अणु वान्डरवाल बल के कारण एक-दूसरे के पास रहते हैं अतः O2 गैस है।
प्रश्न 32. ऑक्सीजन व नाइट्रोजन की भाँति आर्गन द्विपरमाणु अणु नहीं बनाता, क्यों ?
उत्तर⇒ आर्गन परमाणु के बाह्य कक्ष में सभी उपकक्षक इलेक्ट्रॉन से भरे हैं अतः आर्गन परमाणु की इलेक्ट्रॉन ग्रहण करने की क्षमता कम या न के बराबर है जबकि ऑक्सीजन और नाइट्रोजन में आयनिक इलेक्ट्रॉन है जो आपस में इलेक्ट्रॉन का साझा करते हैं जिससे N2 व O2 अणु बनते हैं।
प्रश्न 33. क्या कारण है कि :
(i) XeF3 और XeF5 जैसे फ्लोराइड जिनॉन नहीं बनाता।
(ii) आदर्श गैसों में केवल जिनॉन यौगिक बनाता है।
उत्तर⇒ (i) जिनॉन के सभी उपकक्षक पूर्ण भरे हैं sp उपकक्षक से 5Cl उपकक्षक में इलेक्ट्रॉन का उत्सर्जन से दो, चार या छह उपकक्षक अर्द्धपूर्ण हो जाते हैं। इसलिए जिनॉन सम संख्या में फ्लोरीन परमाणुओं से आबंध बनाकर फ्लोराइड बनाता है। लेकिन XeF3 और XeF5 जैसे फ्लोराइड नहीं।
(ii) रेडॉन एक रेडियोएक्टिव तत्व है ? जिनॉन की आयनन ऊर्जा बाकी आदर्श गैसों से कम है। यह आसानी से क्रिया कर रसायन यौगिक बनाता है।
प्रश्न 34. KI विलयन में Cl2 डालने से भूरे रंग के अवक्षेप बनते हैं परन्तु अधिक मात्रा में Cl2 डालने से रंगहीन हो जाता है क्यों ?
उत्तर⇒ Cl2 एक प्रबल ऑक्सीकारक है I2 की तुलना में KI विलयन को ऑक्सीकृत कर I2 बनता है। जिससे भूरा रंग उत्पन्न होता है।
2KI (aq) + Cl2 (aq) → 2KCl(aq) + I2(s)
यदि अधिक मात्रा में Cl2 गैस गुजारी जाती है तथा I2 ऑक्सीकृत हो जाता है जिससे HIO3 बनता है जो रंगहीन है।
SCl2 + I2 + 6H2O → 10HCl + 2HIO3 ।
प्रश्न 35. फ्लोरीन परिवर्तनशील संयोजकता का प्रदर्शन नहीं करता है। कारण दें।
उत्तर⇒ फ्लोरीन (F) की इलेक्ट्रॉनिक संरचना ls2 2s2 2px2 2py2 2pz1 है जिसमें उत्तेजित अवस्था के दौरान केवल एक ही आधा भरा हुआ कक्षक है और कोई d-कक्षक मौजूद नहीं है। अतः फ्लोरीन (F) एक ही ऑक्सीकारक अवस्था (या संयोजकता) दर्शाता है।
प्रश्न 36. आप बोरॉन (B) और एलुमिनियम (AI) ऑक्साइड कैसे बनायेंगे ?
उत्तर⇒ बोरॉन (B) के ऑक्साइड बोरॉन को ऑक्सीजन की उपस्थिति में जलाने से प्राप्त होता है।
4B + 3O2![]() 2B3O3
2B3O3
ऐलुमिनियम का ऑक्साइड एलुमिनियम को ऑक्सीजन की उपस्थिति में जलाने से तैयार होता है।
4Al + 3O2![]() 2Al2O3
2Al2O3
प्रश्न 37. सिलिकोल क्या है ?
उत्तर⇒ वैसा संश्लिष्ट पदार्थ जिसमें Si-O-Si बंध उपस्थित रहता है. सिलिकोल कहलाता है। सिलिकोल में R2SiO की पुनरावर्ती इकाई होती है।
सिलिकोल का प्रयोग, सील लगाने, ग्रीज के रूप में तथा विद्युतरोधी के रूप में होता है।
सिलिकोल R2SiCl2 के जल अपघटन के फलस्वरूप प्राप्त होता है।

प्रश्न 38. सिलिका (SiO2) से आप क्या समझते हैं ? सिलिका का शुद्धतम रूप क्या है ? सिलिका को प्रयोगशाला में किस प्रकार बनाया जा सकता है ? दो भिन्न विधियों का वर्णन करें।
उत्तर⇒ SiO2 को सिलिका कहते हैं। यह प्रकृति में बालू की तरह विस्तार रूप में बँटा हुआ है।
सिलिका का शुद्ध रूप- प्रयोगशाला में सिलिका का निर्माण-
(i) सिलिकन टेट्राक्लोराइड SiCl4 के जल अपघटन द्वारा-
SiCl4 + 4H2O → H4SiO4 + 4HCl
H4SiO4![]() SiO2 + 2H2O
SiO2 + 2H2O
प्रश्न 39. नाइट्रोजन की क्रियाशीलता फॉस्फोरस से भिन्न क्यों है ?
उत्तर⇒ नाइट्रोजन की क्रियाशीलता फॉस्फोरस तुलना में भिन्न-भिन्न । कारणों से की है
(i) आकार छोटा
(ii) उच्च आयनन एन्थैल्पी तथा वैद्युतऋणात्मकता
(iii) d-कक्षक की अनुपस्थिति
(iv) नाइट्रोजन में pπ – Pπ बहुआबंध बनाने की क्षमता होती है जो स्वयं तथा दूसरे परमाणुओं के साथ बना सकता है।
प्रश्न 40. क्या PCl5 ऑक्सीकारक और अपचायक दोनों कार्य कर सकता है ? तर्क दीजिए।
उत्तर⇒ PCl5 अणु में फॉस्फोरस की अधिकतम ऑक्सीकरण अवस्था + 5 है। यह कम होकर + 3 भी हो सकती है। अतः यह ऑक्सीकारक की भांति कार्य कर सकता है।
PCl3 + H2 PCl3 + 2HCl
PCI5 + 2Ag 2AgCl + PCl3
क्योंकि PCl5 में फॉस्फोरस की अधिकतम ऑक्सीकरण अवस्था है इसलिए इससे और अधिक ऑक्सीकरण अवस्था नहीं हो सकती।
प्रश्न 41. क्यों डाइऑक्सीजन एक गैस है जबकि सल्फर एक ठोस है ?
उत्तर⇒ ऑक्सीजन के छोटे आकार के कारण ऑक्सीजन पर उपस्थिति अआबंध इलेक्ट्रॉन में प्रतिकर्षण होता है जबकि S-S में सल्फर का आकार बड़ा होने के कारण प्रतिकर्षण कम होता है। परिणामस्वरूप O-O आबंध के लिए वियोजन ऊर्जा कम होती है। दूसरे शब्दों में सल्फर सहआबंध की उच्च योग्यता रखता है। तथा pπ – pπ आबंध के लिए उच्च योग्यता रखता है।
ऑक्सीजन प्रबल स्थायी द्विपरमाणु O2 अणु बनाता है। जबकि ऑक्सीजन ऐसा नहीं करता।
प्रश्न 42. हैलोजन प्रबल ऑक्सीकारक क्यों होते हैं ?
उत्तर⇒ हैलोजन प्रबल ऑक्सीकरण हैं क्योंकि इनमें इलेक्ट्रॉन ग्रहण करने की प्रबल क्षमता है।

प्रश्न 43. ClO2 के दो उपयोग लिखिए।
उत्तर⇒ (i) क्लोरीन डाइऑक्साइड ClO2 प्रबल ऑक्सीकारक है।
(ii) यह क्लोरीकारक है और इसकी ब्लीच क्षमता Cl2 की तुलना में 30 गुणा अधिक है।
प्रश्न 44. हैलोजन रंगीन क्यों होते हैं ?
उत्तर⇒ हैलोजन अणु प्रकाश का अवशोषण करते हैं जब बाहरी इलेक्ट्रॉन उत्तेजित होकर उच्च ऊर्जा स्तर को छता है तथा वापस लौटते समय विकिरण उत्सर्जित करता है जिस कारण हैलोजन अणु रंगीन होते हैं।
प्रश्न 45. समुद्र कुछ हैलोजन का मुख्य स्रोत है। टिप्पणी कीजिए।
उत्तर⇒ हैलोजन के लिए महासागर प्रमुख स्रोत है। समुद्री जल में क्लोराइड, ब्रोमाइड और आयोडीन के लवण मिलते हैं। जब पानी को सुखाया जाता है तब लवणों को प्राप्त करते हैं।
KCl, MgCl26H20 तथा 0.5% मात्रा में आयोडीन।
class 12th chemistry Subjective question 2022
| S.N | CHEMISTRY ( रसायन विज्ञान ) SUBJECTIVE |
| 1 | ठोस अवस्था |
| 2 | विलयन |
| 3 | वैधुत रसायन |
| 4 | रसायन बलगतिकी |
| 5 | पृष्ठ रसायन |
| 6 | तत्वों के निष्कर्षण के सामान्य सिद्धांत |
| 7 | p-ब्लॉक के तत्व |
| 8 | d एवं -ब्लॉक के तत्व |
| 9 | उप-सहसंयोजक यौगिक |
| 10 | हैलोएलकेन्स तथा हैलोऐरिन्स |
| 11 | ऐल्कोहॉल, फीनॉल एवं ईथर |
| 12 | ऐल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल |
| 13 | ऐमीन |
| 14 | बहुलक |
| 15 | जैव अणु |
| 16 | दैनिक जीवन में रसायनऔर विविध |




